PARylated PDHE1α generates acetyl-CoA for local chromatin acetylation and DNAdamage repair
《nature structural & molecular biology》(IF=16.8008)
摘要:
染色质松弛是DNA修复机制进入双链断裂(DSBs)的先决条件。dsb周围的局部组蛋白随后会发生乙酰化状态的迅速变化,但如何满足乙酰辅酶a的巨大需求尚不清楚。
在这里,我们报道了丙酮酸脱氢酶1α(PDHE1α)催化丙酮酸代谢,快速提供乙酰辅酶a,以响应DNA损伤。我们发现PDHE1α以多聚adp核糖化依赖的方式被快速招募到染色质,这驱动乙酰辅酶a的生成,以支持dsb周围的局部染色质乙酰化。这一过程增加了松弛染色质的形成,以促进修复因子加载、基因组稳定性和癌细胞对dna损伤治疗的抗性。
事实上,我们证明了阻断基于聚adp-核糖基化的PDHE1α染色质招募可以减弱染色质弛豫和DSB修复能力,导致基因组不稳定性和恢复放射敏感性。这些缺陷支持了一种机制,即染色质相关的PDHE1α局部产生乙酰辅酶a,以重塑与dsb相邻的染色质环境,并促进其修复。
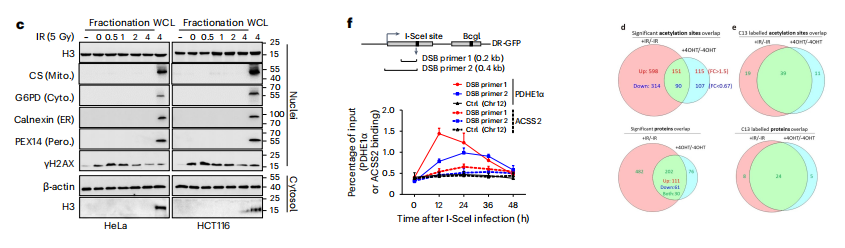
定义染色质乙酰化的动态应对DNA损伤,我们评估了染色质和酸提取部分的赖氨酸乙酰化,研究发现,在DNA损伤治疗后,整体赖氨酸和核心组蛋白乙酰化水平均以剂量和时间依赖性的方式短暂增强。
通过染色质免疫沉淀(ChIP)检测,4-OHT处理诱导了DSBs周围泛Ac信号约3倍的富集。我们接下来发现,ACSS2和PDHE1α都被招募到染色质中,而不是ACLY,而ACSS2到染色质中的招募仅在10 Gy时增强。
我们的结果还表明,所有这三种成分都以时间和剂量依赖的方式定位于染色质部分。我们进一步应用了接近连接试验(PLA),并观察到PDHE1α和γH2AX之间的原位内源性相互作用对应的红点。
内源性PDHE1α与γH2AX和泛赖氨酸乙酰化信号在激光条纹中共定位的积累进一步证实了这一结论。
我们发现,激光触发了外源性过表达的GFP标记PDHE1α和内源性GFP敲入融合PDHE1α对激光条纹的显著和快速积累。
这些结果共同表明,PDHE1α被招募到染色质上对于乙酰辅酶a的生成和染色质的乙酰化反应至关重要。
为了说明富含染色质的PDHE1α的功能,我们首先使用高响应的丙酮酸传感器NLS-PyronicSF/pCMV-myc-nuc监测丙酮酸动态,我们观察到微照射后,丙酮酸在DSB条纹周围的快速积累,这种效应在PDHE1α缺陷细胞中被消除。
为了说明丙酮酸在DSB周围的流动,我们用13C同位素标记丙酮酸,在DNA损伤时,在DSB位点检测到大量的蛋白质和乙酰化多肽。
对13个c标记的乙酰化蛋白进行乙酰组蛋白质组学分析,发现由丙酮酸衍生的乙酰供体主要是DNA损伤的结果。揭示了染色质重组与乙酰辅酶a代谢以及DDR之间的联系。
进一步评估激光诱导的DNA损伤位点的泛Ac水平显示,在DNA损伤轨道上,泛Ac信号显著增加,这种效应在很大程度上被PDHE1α消耗所抑制,而ACLY或ACSS2消耗没有被抑制。
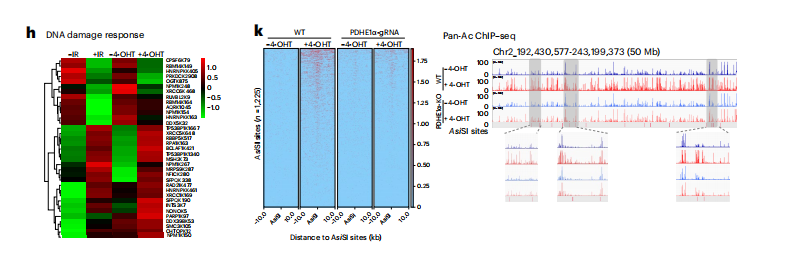
这些观察结果表明,PDHE1α衍生的局部乙酰辅酶a的产生确实对染色质的乙酰化很重要。此外,使用泛ac特异性抗体进行ChIP和测序显示,在野生型处理中,4-OHT处理后,asisi生成的dsb中分布的泛ac峰高度富集,而PDHE1α缺陷组没有富集。
总的来说,PDHE1α介导的乙酰辅酶a的生成是DSBs周围染色质乙酰化所必需的。
为了探索将PDHE1α招募到染色质的调控网络,我们使用IP-MS分析来识别潜在的PDHE1α相互作用子。
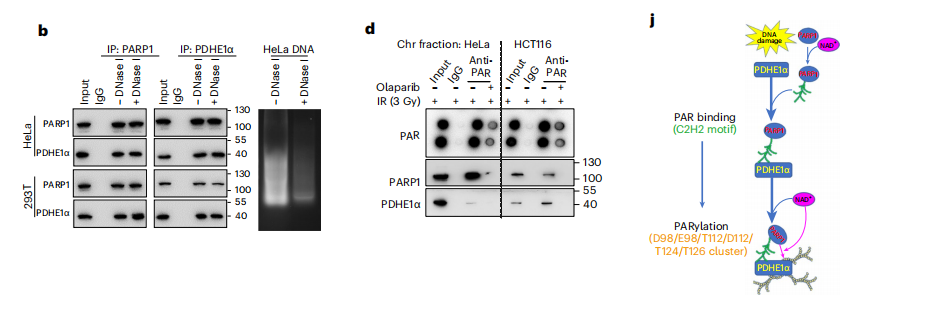
我们发现PDHE1α最稳定富集的候选基因是PARP1,它们的相互作用并不依赖于DNA。为了确认PDHE1α的募集是否依赖于PARP1,我们将PARP1抑制剂预处理的细胞,发现PDHE1α的募集对染色质的相互作用显著减少。
我们通过ChIP实验进一步发现,奥拉帕尼治疗抑制了内源性PDHE1α与DSB位点的结合,通过化学和遗传抑制,消除了dsb中符合丙酮酸代谢活性的外源PDHE1α的积累激光微辐照系统。这些数据表明,PARP1的活性对于PDHE1α招募到DNA损伤位点至关重要。
为了排除PDHE1α是否被PARP1直接核糖基化,我们使用PDHE1α或PAR抗体进行了变性IP。
我们检测到明显的聚化PDHE1α信号,表明PDHE1α在DNA损伤时被PAR共价修饰。使用IP浓缩蛋白,我们发现PARP1和聚合PDHE1α水平大大增加受损细胞染色质部分,和染色质PDHE1α的存在被PARP1抑制。
因此,这些数据证实了PDHE1α在体内和体外都可以被PARP1聚醚化。PDHE1α是一个潜在的par结合候选者。
我们进一步检测了PDHE1α不同区域的PAR结合敏感性,发现PDHE1α的91-190aa区域表现出明显的IR诱导的PAR信号。我们用丙氨酸删除或替换了这些残基,并确定了其对PDHE1αpar结合和招募的影响。
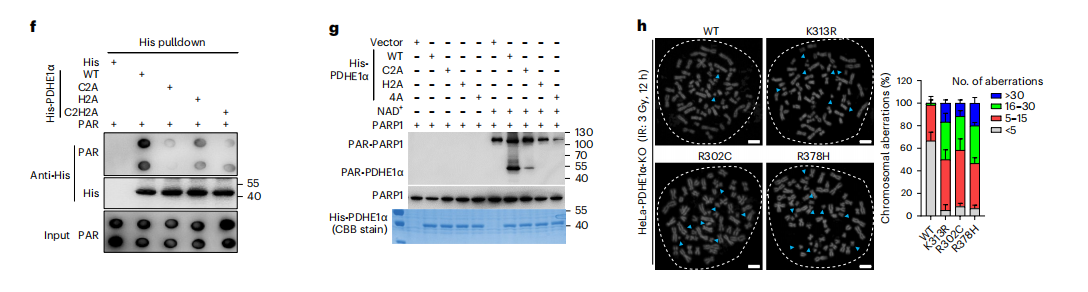
结果显示,这些残基的缺失或替代显著降低了PDHE1α的par结合水平。体外par结合实验进一步证实了这种效应。此外,par结合基序的突变消除了PDHE1α在受损位点的积累,表明PDHE1α的par结合是其pary化的关键。
我们的观察表明PDHE1α通过其PAR结合基序结合PAR链,这种相互作用促进了PARP1在多个残基上的PARylate PDHE1α。
为了解PDHE1αpar结合对其酶活性的影响,我们拯救PDHE1α结合缺陷突变体PDHE1α敲除(KO)细胞,发现这些突变体没有PDHE1α酶活性的变化,但显示明显减少双边带网站响应红外。通过对asisi生成的dsb中泛ac信号的ChIP-seq分析,进一步验证了这一结论。
接下来,我们进行了微球菌核酸酶(MNase)敏感性试验,数据显示,依托泊苷处理增加了MNase对WT细胞染色质的可及性,而不是PDHE1α-KO细胞,这表明单/di/三核小体的密度显著增加。
接下来,我们克隆了三个酶活性死亡的临床热点突变的PDHE1α,K313R、R302C和R378H。我们首先证实了这些突变体没有酶活性。此外,这些突变体并不影响其招募,但不能调节泛ac。
同样,挽救这些酶死亡的突变体并不能增加染色质的可及性以及修复因子对DNA损伤的加载能力。这些结果表明,PDHE1α配对化和酶活性是确保DNA损伤后染色质可及性所必需的。
为了了解富含染色质的PDHE1α在DDR中的功能,用彗星实验来检测单个细胞中的DNA损伤。我们观察到,在DNA损伤8小时后,有更高比例的PDHE1α-KO细胞含有残留的DSB病变)。
通过使用γH2AX作为替代标记物监测DSB积累动力学,我们发现PDHE1α缺失不仅导致DSB延迟积累,而且增加了DNA损伤后8小时持续DSB的细胞百分比。这些观察结果共同表明,PDHE1α在DSB修复中起着重要的作用。
我们进一步观察到,par结合缺陷突变体未能挽救DNA损伤后尾部时刻持续的DNA损伤水平。通过将不同的PDHE1α构建物拯救到PDHE1α缺陷细胞中,修复报告系统进一步证实了这一结论。
最后,我们通过评估DSB修复后PDHE1α缺陷细胞的染色体断裂,进一步分析了染色体的稳定性。我们发现,PDHE1α缺失显著增加了染色体断裂,由于DNA损伤修复效率的降低,par结合和酶活性死亡的突变体都有更多的染色体断裂。
这些数据表明,染色质富集的PDHE1α在促进DSB修复以维持基因组稳定性方面具有关键作用。

为了表征PDHE1α在基因毒性耐药性中的生物学相关性,我们对细胞进行了IR处理,集落形成试验显示,PDHE1α缺陷的细胞对IR处理表现出超敏性。挽救par结合缺陷突变体并没有逆转PDHE1α缺陷引起的敏感性。
为了检测PDHE1α是否参与了对基因毒性治疗的耐药性,我们评估了接受化疗/放疗患者的临床乳腺癌组织中PDHE1α/泛ac信号轴的临床相关性。
PDHE1α高的表达与高泛酸信号呈正相关,高PDHE1α表达和泛酸水平对接受基因毒性治疗的患者总生存率显著降低,表明PDHE1α在基因毒性治疗耐药中具有关键的临床相关性。
我们使用PDHE1α-KO C57小鼠模型进一步评估了PDHE1α在放疗耐药性中的作用。PDHE1α缺陷小鼠(Pdha1f/f;CMVCre)的寿命较短,与Pdha1f/f小鼠相比,放射治疗后萎缩的修复被延迟。
CMVCre小鼠的空肠组织中存在高水平的残留DNA损伤和凋亡,但放疗后的泛ac水平较低。总之,这些结果表明,PDHE1α的表达赋予了体内细胞的辐射抗性。
接下来,我们将稳定表达PDHE1αpar结合缺陷突变体的克隆注射到裸鼠中,并监测皮下肿瘤在体内对DNA损伤的反应。与WT组相比,par结合缺陷肿瘤对放射治疗的敏感性显著增强,但对小鼠体重没有影响,表明染色质PDHE1α在体内肿瘤的放射耐药中起着关键作用。
这些结果表明,PDHE1α的配对修饰显著有助于癌细胞对dna损伤治疗的耐药性。
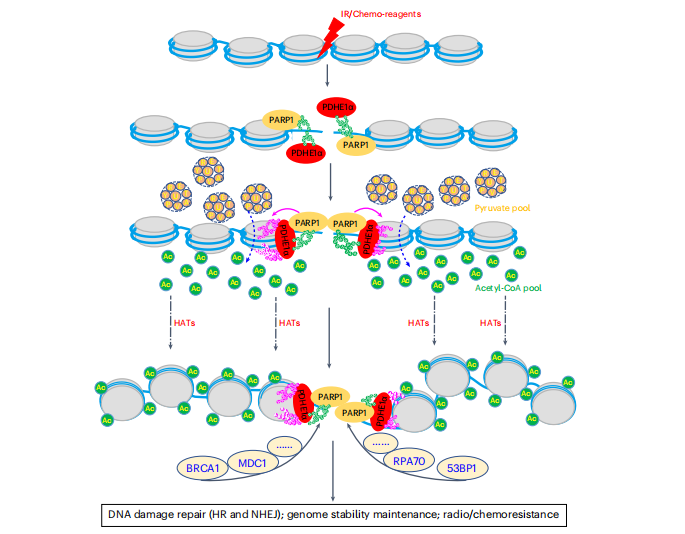
在本研究中,我们展示了PDHE1α在DSB位点以pary化依赖的方式催化局部乙酰辅酶a生物合成和染色质乙酰化的时空功能(图8)。本报告中的研究结果强调了乙酰辅酶a的来源以及染色质相关的PDHE1α在DSB修复和放化疗耐药性中的作用。
我们的发现为进一步研究局部代谢物在表观遗传调控中的作用以及开发调节癌症代谢的PDHE1α靶向治疗提供了动力,最重要的是,破坏癌细胞抵抗基因毒性损伤的关键机制。

作者使用伯信生物明星产品Reverse-ChIP试剂盒进行了上述筛选与分子互作调控机制的研究。




