Periodic changes of cyclin D1 mRNA stability are regulated by PC4 modifications in the cell cycle
《Journal of Cell Biology》(IF=7.4001)
细胞周期是一个高度调控的过程,其中参与细胞周期进程的蛋白质表现出周期性的表达模式,受特定的机制控制,如转录、翻译和降解。然而,细胞周期调节因子中mRNA水平振荡的确切机制尚未完全清楚。
在本研究中,我们观察到cyclin D1(CCND1)mRNA的稳定性在细胞周期中波动,间期稳定性增加,M期稳定性降低。
此外,我们还鉴定了一个关键的RNA结合蛋白,阳性共激活因子4(PC4),它在稳定CCND1 mRNA和调节其周期性表达中起着关键作用。
此外,PC4与CCND1 mRNA的结合亲和力受两种细胞周期特异性翻译后修饰的调节:K68的泛素化增强间期的结合并稳定CCND1转录本,而S17的磷酸化抑制M期的结合,导致CCND1 mRNA的降解。
值得注意的是,PC4促进了细胞周期中从G1期向S期的过渡,而PC4的消耗增强了CDK4/6抑制剂在肝细胞癌中的疗效,提示PC4可能是一个潜在的治疗靶点。这些发现为细胞周期动力学的复杂调控提供了有价值的见解。
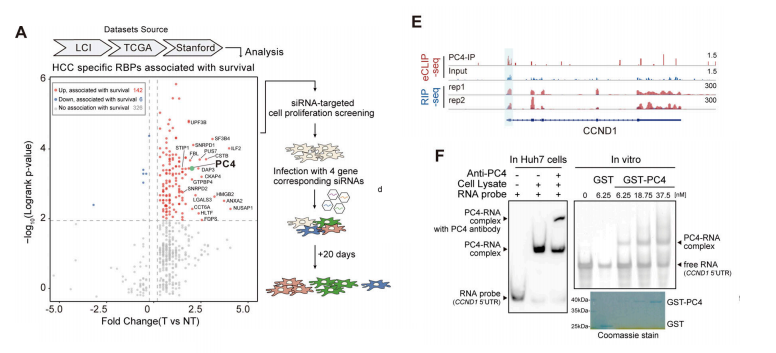
为了识别促进和维持HCC并可能作为潜在治疗靶点的rbp,我们开发了一个两步筛选系统。经过第二次细胞增殖筛选后,PC4敲除对HCC细胞生长的抑制作用最为显著。
由于PC4已被认为为一种潜在的RBP,我们接下来使用PC4 RIP-seq分析确定了Huh7细胞中与PC4直接结合的RNA转录本。为了精确地检测PC4对其结合转录本的影响,我们对PC4敲低的Huh7细胞进行了RNA-seq分析。
大多数与PC4基因结合和调控的基因的mRNA表达显著下降。这些基因在细胞周期途径中富集,表明PC4作为一个RBP,调节细胞周期相关的mRNA靶点,控制细胞周期进程,促进细胞增殖。
为了进一步了解PC4是否参与细胞周期机制控制,我们对三种肝癌细胞系进行了RNA-seq分析,证实了PC4可能通过直接与RNA结合而对细胞周期产生影响。
我们仔细考虑了5个在PC4敲低后显示下调的转录本,它们参与了RB:E2F激活和细胞周期G1/S相变。通过mRNA半衰期测定,我们发现在PC4敲除后,这5个基因的mRNA稳定性要低得多。
CCND1因其在细胞周期进程中的重要作用而脱颖而出,并且在PC4缺失后其差异表达量最高;为了确定PC4如何调控CCND1 mRNA的代谢,通过增强交联和免疫共沉淀验证了PC4蛋白和CCND1 mRNA之间的特异性结合,然后进行了下一代测序(eCLIP-seq)。
PC4更倾向于与CCND1 mRNA的59UTR结合。此外,EMSA的结果都证实了这种结合。rip-qPCR、RNA下拉和FISH分析显示,这种相互作用发生在不同的肝癌细胞中。
我们证实了在PC4敲低后,CCND1的衰减率更高,而PC4过表达显著延长了CCND1 mRNA的半衰期。此外,PC4缺失显著降低了CCND1mRNA和蛋白水平。然而,在PC4-OV细胞中却观察到相反的作用,表明PC4与CCND1 mRNA相互作用并使其稳定,导致CCND1蛋白表达增强。
值得注意的是,PC4的缺失并没有改变CCND2或CCND3的mRNA表达,表明PC4特异性调控CCND1的表达。这些结果表明,PC4在转录后调控CCND1基因的表达,而不依赖于其作为co-TF的经典功能。
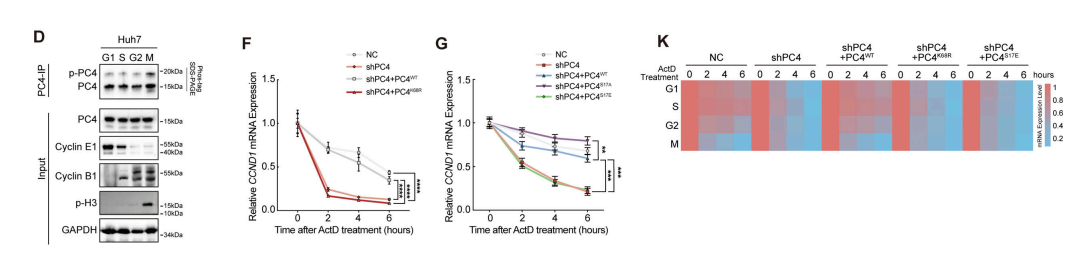
我们想知道PC4的PTMs是否在整个细胞周期中表现出波动模式。我们从同步的Huh7细胞中免疫沉淀PC4,并使用质谱(MS)鉴定了PC4的修饰。两个周期性变化的修饰引起了我们的注意:(1)68位赖氨酸(K68)泛素化;(2)17位丝氨酸磷酸化(S17)。
为了证实K68的泛素化,我们用精氨酸替换赖氨酸残基,创建了PC4的K68R突变体(PC4K68R).在Huh7和HepG2细胞中,PC4K68R导致了泛素化的显著减少,证实了PC4的K68泛素化。
PC4泛素化水平在g1期、S期和g2期显著增加,但在M期几乎未检测到。相比之下,PC4K68R的泛素化水平在整个细胞周期中保持不变,表明PC4经历了K68间期的泛素化。
接下来,为了验证S17磷酸化的存在,我们建立了一系列PC4突变体。我们在PC4重新表达WT或PC4S17E的PC4缺失细胞中检测到这种磷酸化信号,但在重新表达PC4S17A的细胞中没有观察到磷酸化信号。
我们还监测了细胞周期中S17磷酸化的变化。与MS观察结果一致,PC4的磷酸化水平在M期达到峰值,在其他期逐渐下降。
在PC4基因敲低的细胞中,PC4WT的重新表达挽救了CCND1 mRNA的稳定性。相比之下,PC4K68R失去了这种能力,表明K68泛素化介导了PC4稳定CCND1 mRNA的作用。
进一步的实验表明,PC4K68R和PC4S17E都不能诱导CCND1 mRNA或蛋白的表达。值得注意的是,在PC4敲低的细胞中,过表达PC4WT逆转了CCND1 mRNA表达和整个细胞周期的稳定性波动,而不是PC4K68R或PC4S17E。
这些数据表明,PC4是一种细胞周期调控蛋白,在间期K68泛素化,在M期S17磷酸化。这两种修饰对pc4介导的CCND1 mRNA稳定性的调节有相反的作用,这可能导致了细胞周期中CCND1表达的波动。
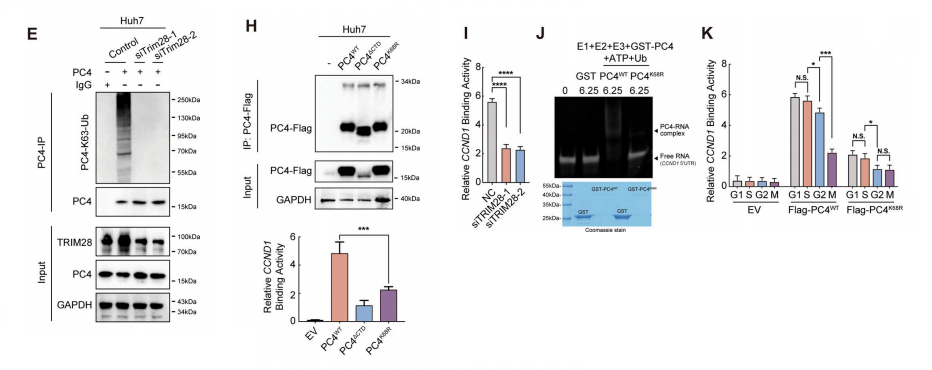 为了进一步探索PC4在K68位点的泛素化增加CCND1 mRNA稳定性的机制。我们检测了同步Huh7细胞中与PC4的相互作用组,发现TRIM28,一个包含RING结构域的E3泛素连接酶,在间期与PC4特异性相关。
为了进一步探索PC4在K68位点的泛素化增加CCND1 mRNA稳定性的机制。我们检测了同步Huh7细胞中与PC4的相互作用组,发现TRIM28,一个包含RING结构域的E3泛素连接酶,在间期与PC4特异性相关。
通过IP实验验证了细胞周期依赖的相互作用。使用重组蛋白的体外泛素化实验提供了额外的证据,证明PC4的多泛素化只在TRIM28存在时发生。
TRIM28介导的k63连接的PC4多泛素化显著降低。在体外和Huh7细胞中,TRIM28都不能泛素化K68r突变的PC4,这表明TRIM28对PC4在K68上的泛素化至关重要。
当K68泛素化被破坏时,PC4K68R与CCND1转录本的结合能力明显较弱,在一定程度上类似于c端结构域(PC4ΔCTD)的耗尽,当Huh7细胞中TRIM28被沉默时,PC4-CCND1的相互作用被显著抑制。
此外,重组PC4K68R在体外对mRNA的结合亲和力要低得多,这凸显了K68泛素化在支持PC4与CCND1 mRNA相互作用中的重要性。K68泛素化可能是周期性控制PC4-CCND1mRNA相互作用的重要因子。
在间期,K68泛素化水平相对较高,相互作用相对稳定。在M期,随着K68泛素化程度的充分降低,相互作用减弱。
因此,TRIM28过表达进一步提高了PC4间期下调的PC4WT细胞中K68泛素化水平、PC4-CCND1mRNA结合和CCND1 mRNA的稳定性;然而,在PC4K68R细胞中,这种作用受到了损害。
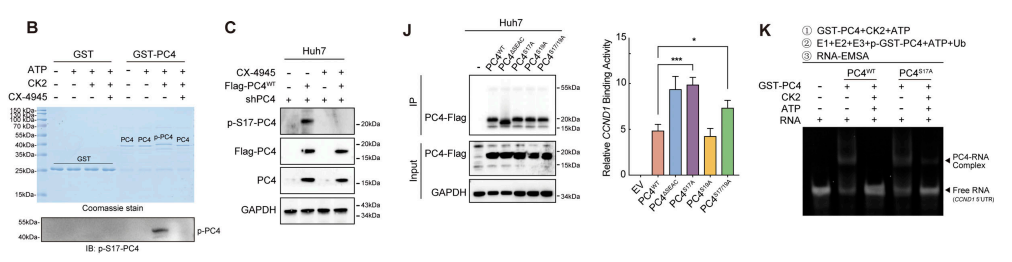
我们研究了S17是否可以成为CK2磷酸化的靶点。与预期的一样,CK2在M期与PC4特异性地相互作用,并有效地磷酸化了PC4。与PC4WT相比,PC4S17A适度提高了PC4的k63连接的泛素化水平,而PC4S17E显著降低了这一水平。
沉默CK2增强了PC4WT细胞中k63连接的泛素化,但不影响PC4S17A细胞中泛素化的丰度。这些结果表明,PC4泛素化发生在S17去磷酸化之后。
接下来,我们确定了S17磷酸化是否抑制了TRIM28和PC4之间的关联。Co-IP分析显示,S17磷酸化阻止了TRIM28-PC4的相互作用,并抑制了下游的泛素化。
在PC4WT细胞中,抑制CK2增强了这种相互作用,以及trim28介导的PC4-k68连接的多泛素化,而CK2过表达则阻断了这些事件。体外实验表明,ck2导向的PC4 S17磷酸化破坏了TRIM28和PC4之间的结合,从而抑制了随后的K68泛素化。
与PC4WT或PC4S19A突变体相比,PC4S17A显著增强了CCND1 mRNA的结合亲和力。PC4S17A维持了与细胞周期相关的PC4-CCND1mRNA关联的波动,而PC4S17E未能发挥这一作用。
CK2在PC4WT细胞中中断了周期性变化的CCND1转录本的稳定性。因此,PC4是一种依赖于细胞周期的RBP,其RNA结合功能是通过在整个细胞周期阶段的磷酸化-泛素化开关来决定的。
在间期,trim28促进的K68泛素化开关PC4的功能“on”,以增强与CCND1 mRNA的相互作用和稳定。在有丝分裂进入后,ck2催化的S17磷酸化通过将PC4与TRIM28和CCND1 mRNA完全分离,导致PC4“关闭”功能,导致CCND1 mRNA降解。
这两种动态控制的修饰进一步强调了PC4作为一种参与细胞周期进程的RBP,并且可能是允许PC4在细胞周期中控制CCND1 mRNA稳定性的关键因素。
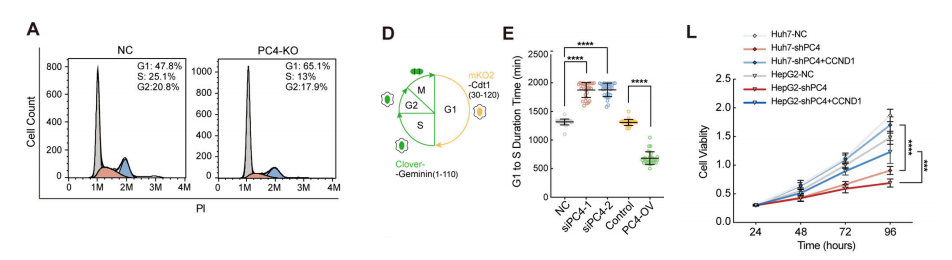
为了研究PC4对细胞周期动力学的总体影响,我们首先对非同步细胞进行了流式细胞术。与预期的一样,PC4缺失导致G1期细胞的升高,伴随着非g1期(G2/M/S)的减少,将PC4与细胞周期过渡联系起来。
与对照组相比,PC4消耗显著损害了G1/S过渡,因为细胞进入S期的比例较低.我们还使用Huh7-FUCCI构建了一个模型,并进行了延时显微镜来评估G1/S的转变。PC4敲低在延长10小时后导致G1期持续时间显著增加。相反,PC4过表达通过缩短一半的持续时间来缩短G1期。
接下来,我们确定了PC4对肝癌发生发展的影响。PC4敲除或敲除(KO)在体外和体内均显著损害了Huh7和HepG2细胞的增殖.PC4在PC4沉默的HCC细胞中的重新表达进一步证实了特异性,这逆转了这种表型。这些结果表明,PC4是一种细胞周期调节因子,驱动g1-S过渡,促进肝癌细胞增殖。
我们预计CCND1的缺失可能会导致PC4的缺失。事实上,在肝癌细胞中下调CCND1导致G1期持续时间延长和细胞生长受损,尽管表型效应不像PC4敲低观察到的显著影响那样显著。
CCND1单独或与PC4联合缺失对抑制细胞增殖的程度相似,这表明CCND1和PC4参与了相同的通路。PC4加速了G1/S相变,这部分依赖于CCND1。
鉴于PC4通过调控其他细胞来促进细胞周期进程的潜在作用关键的G1/S调节因子,如SKP2,我们通过将SKP2重新引入PC4耗尽的细胞中,进行了拯救实验。
这些结果进一步支持了我们的假设,即PC4通过影响对G1/S相变至关重要的因子的表达,在细胞周期进程中发挥重要作用。
总的来说,我们的研究结果揭示了PC4在稳定细胞周期关键调控因子mRNA方面之前未被认识到的作用,这反过来促进G1/S转化并加速肝癌细胞增殖。
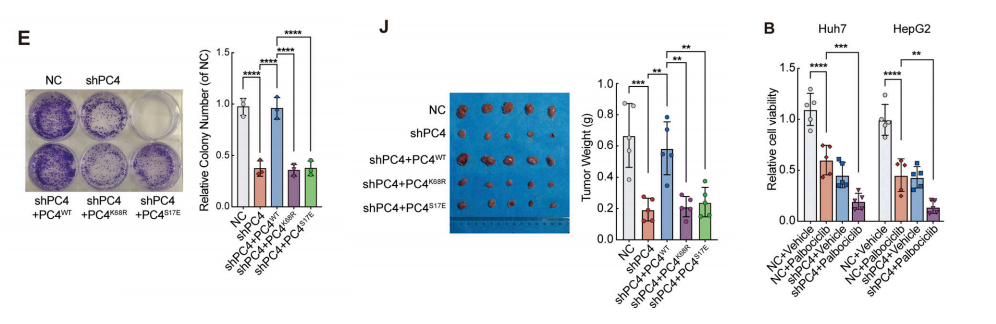
为了进一步验证PC4是否利用这两种修饰来操纵细胞分裂周期,我们进行了几个拯救实验,PC4WT显著克服了PC4缺失介导的G1期延长,但两个突变体都没有克服。
这两个突变体都没有诱导细胞增殖,表明这两种修饰协调了S期进入和细胞生长。使用异种移植小鼠模型的进一步研究显示,S17磷酸化PC4或K68去泛素化显著降低了细胞生长。
这些数据表明,PC4-RNA结合的S17去磷酸化和K68泛素化是PC4-RNA结合所必需的,这使得PC4可以调节CCND1 mRNA的稳定性和表达,从而维持细胞周期进程和增殖。
我们评估了HCC细胞系和癌症组织中PC4 S17磷酸化和K68泛素化的水平。S17的磷酸化水平在癌细胞和组织中比在正常对照组中要低得多。相比之下,HCC样本中K68泛素化程度较高。
这些结果表明,该开关是“开启”的,因此PC4作为一个RBP,在转录后调控HCC中的细胞周期基因的表达。我们发现,在HCC组织中,CK2和PC4之间的相互作用减少,而TRIM28和PC4之间的相互作用增强。
这些观察结果表明,CK2介导的S17磷酸化和TRIM28诱导的K68泛素化是HCC患者的临床相关过程,提示修饰后的PC4可能是肝癌的有效生物标志物和治疗靶点。
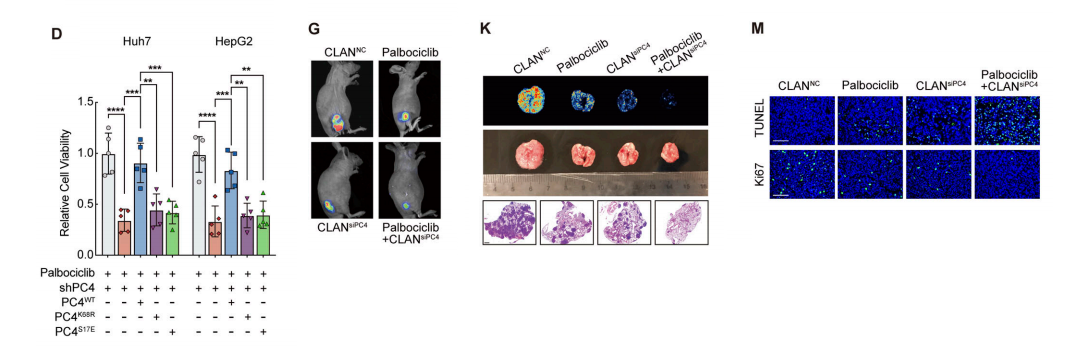
由于PC4缺失会导致细胞周期阻滞,我们试图探索PC4缺失是否会使肝癌细胞对CDK4/6抑制剂敏感。PC4敲低的Huh7和HepG2细胞对Palbociclib处理更敏感。
重新表达PC4WT降低了PC4敲低细胞对Palbociclib的敏感性,而PC4K68R或PC4S17E恢复了这种敏感性。此外,耗尽PC4或抑制其RNA结合能力会导致CCND1和SKP2蛋白水平的降低。
这阻止了RB过度磷酸化介导的E2F激活和随后的与S期进入相关的基因表达。我们创建了一种阳离子脂质辅助的PEG-b-PLA纳米颗粒(CLAN),它将PC4sirna封装在水核内。
携带Huh7-Luc异种移植的裸鼠,一旦肿瘤体积达到100 mm3,用CDK4/6抑制剂Palbociclibib、PC4或Palbociclib和CLANsiPC4联合治疗。
用Palbociclib或CLANsiPC4治疗效果显著,与两种单独治疗相比,Palbociclib联合CLANsiPC4进一步降低了肿瘤负担,提高了总生存期,并抑制了肺转移,表明PC4敲低后对Palbociclib的敏感性增加。
Ki67和TUNEL染色的结果显示表明,这主要是由于抑制细胞增殖和促进细胞凋亡而增强了联合治疗的疗效。
与阻断细胞周期蛋白依赖性激酶的活性相比,PC4的下调通过下调G1/S关键调控因子的蛋白表达来限制细胞周期进程,从而进一步阻止RB的过度磷酸化。因此,PC4缺失和CDK4/6抑制协同诱导细胞周期失调,导致一种可能用于肝癌治疗的脆弱性。
我们的研究结果表明,PC4部分通过影响多种细胞周期调控因子参与细胞周期的mRNA稳定性,特别是CCND1,它在细胞周期进程和细胞增殖中起着关键作用。
更重要的是,间期trim28导向的K68多泛素化和M期ck2介导的S17磷酸化被定义为调节PC4生物学功能和细胞周期中CCND1 mRNA的关键稳定性波动。此外,PC4缺失加剧了CDK4/6抑制剂对HCC生长的抑制作用。
这些发现强调了RBP在驱动细胞周期进程中的重要性,而选择性靶向功能性RBP代表了肝癌治疗的一个很有前途的策略。


作者使用伯信生物明星产品RNA pulldown、RNA EMSA、RNA FISH试剂盒以及分子探针进行了上述筛选与分子互作调控机制的研究。
伯信好物推荐
RNA pulldown Kit
1
产品介绍:
蛋白质与RNA的相互作用是许多细胞生物学过程的核心,如蛋白质合成、mRNA 组装、病毒复制、细胞发育调控等,研究它们之间相互作用的分子机制对理解这些生物学过程非常重要。RNA pulldown技术通过体外转录标记生物素的RNA探针耦联链霉亲和素标记的磁珠,实现了对RNA结合蛋白质(RBPs)的高效富集和鉴定。
伯信RNA pulldown Kit 分为:
Bes5102(S) RNA pulldown kit 12T
Bes5102(N) RNA pulldown kit 40T
实验原理:
针对目标区域设计生物素标记的特异性RNA探针偶联磁珠,并与细胞蛋白提取物孵育,蛋白分子与RNA探针特异性结合,经洗脱,得到目的RNA探针-蛋白质复合物。最后采用Western Blot或质谱鉴定蛋白质类型。
技术流程:
结果实例:
产品优势:
1. 自主品牌:拥有自主知识产权专利。
2. 高品质,稳定性好。
3. 精准:特异性高,背景少。
4. 易用:操作简单,容易上手。
5. 快速省时:全部实验只需3小时。
RNA EMSA Kit
产品介绍:
凝胶迁移或电泳迁移率检测(Electrophoretic mobility shift assay,EMSA)是研究启动子结合蛋白的经典方法,主要应用于定性和定量分析核酸蛋白相互作用。
伯信 RNA EMSA Kit分为:
Bes5107(S) RNA EMSA Kit 12T
Bes5107(N) RNA EMSA Kit 100T
实验原理:
凝胶迁移或电泳迁移率检测(Electrophoretic mobility shift assay,EMSA)是研究启动子结合蛋白的经典方法,主要应用于定性和定量分析核酸蛋白相互作用。
针对目标区域设计特异性核酸探针,并进行末端生物素标记;该探针与蛋白质结合形成复合物,电泳时在凝胶中移动的速度慢(相对于没有结合蛋白的探针),即表现为条带相对滞后。
该方法不仅简单迅速、灵敏度高,还可以用竞争性试验来评价蛋白和核酸结合的特性。目前用于检测DNA/RNA结合蛋白,并可通过加入特异性抗体来检测特定的蛋白质,或是结合蛋白双向电泳与质谱技术鉴定分析未知蛋白。
RNA-EMSA是一种研究RNA结合蛋白(RBPs)和特定RNA序列之间结合作用的技术。本试剂盒提供了进行RNA-EMSA实验的主要试剂,包括蛋白提取、蛋白-RNA结合、电泳与化学发光等,使整体实验变得简单方便。
RNA-EMSA/Gel-Shift结合体系中含有poly(dI-dC)等有效成分,其中,poly(dI-dC)的浓度经过优化,可以很好地消除蛋白和标记探针间的非特异性结合,保证了实验检测的科学严谨性。此外,本试剂盒经去除RNA酶处理,一定程度上避免了实验过程中RNA降解。
技术流程:
产品优势:
1. 安全环保:采用非同位素的化学发光检测系统,免除放射性的危险与处理同位素废物的麻烦,减少环境污染;无需专门的同位素操作室,易于使用推广。
2. 高灵敏度:检测灵敏度高,背景干扰更低。
3. 快速省时:从标记探针到结果分析,全部实验只需5小时。
4. 稳定可靠:DNA末端标记生物素,不影响蛋白结合位点;标记好的DNA/RNA可以保存一年。
5. 配备完整:配备伯信生物细胞核提取试剂盒。
6. 个性化服务:可根据研究需要定制个性化高灵敏度探针。
RNA FISH Kit
产品介绍:
伯信生物建立了荧光原位杂交探针(FISH Probe)制备平台,承接荧光原位杂交试剂盒定制业务,可根据客户需求进行个性化定制。该试剂盒主要用于检测样本中目的基因的表达量与表达部位,可应用于组织切片(石蜡切片/冰冻切片)、细胞爬片与染色体片等的检测。伯信生物采用从研究物种自体获取特异性探针并进行化学共价方式与荧光素连接。
自体荧光探针具有明显的优越性:灵敏度高,光稳定性好,荧光寿命长;最大的优势就是自体探针可以有效的降低自体的非特异荧光干扰,达到更加高效特异的基因检测信号。
通过对比将会产生极大的技术效应,获取客户的认可并替代传统的探针检测,满足国内外科研工作者对高质量的荧光探针原位杂交试剂盒的实验需求。
伯信生物荧光原位杂交试剂盒,自上市以来深受广大科研用户的欢迎和肯定,为中国科学院、中山大学医学院及附属医院、南方医科大学医学院及附属医院、香港大学、北京大学医学部及附属医院、东南大学医学院、江西农业大学、华中科技大学同济医学院等国内一流科研院所、医疗机构及跨国生物企业等近千家用户提供了优质的服务。
同时经过多年的积累,2011年建立了分子探针研发中心,伯信生物拥有强大的荧光原位杂交技术团队,为客户在试剂盒使用中遇到的各种问题给予技术支持和解答。
目前公司拥有库存现货试剂盒种类已达近万种:其中mRNA 1245种;microRNA 3171种,种属涵盖人、大小鼠、兔、猪、鸡、细菌、昆虫类等等,以及其他常规染色体探针及种属特异性探针等。
伯信 RNA FISH Kit分为:
Bes1001(S) RNA FISH(短链) Kit 30T
Bes1001 (N) RNA FISH(短链) Kit 50T
Bes1001 (M) RNA FISH(短链) Kit 100T
Bes1002 (S) RNA FISH(长链) Kit 30T
Bes1002 (N) RNA FISH (长链)Kit 50T
Bes1002 (M) RNA FISH (长链)Kit 100T
实验原理:
荧光原位杂交(Fluorescent in situ hybridization, FISH)是根据待测核酸序列设计特异性的荧光素标记寡聚核苷酸探针,再经过共变性-退火-复性,使探针与靶DNA/RNA按照碱基互补配对原则形成杂交体,最后利用荧光显微镜直接检测荧光信号,从而对组织、细胞中的待测核酸进行定性、半定量或相对定位分析的一种原位杂交技术。
技术流程:
结果实例:
产品优势:
1. 探针制备采用直接标记法,省去了信号放大系统。
2. 荧光信号强,结果判定直观可靠。
3. 根据客户需求定制个性化探针。
4. 特异性强,灵敏度高,背景低。
5. 探针性能稳定,低温保存一年以上。
6. 同时示踪核酸和蛋白的定位情况。
7. 操作简单,安全、快速,重复性好。




