Hypoxia promotes EV secretion by impairing lysosomal homeostasis in HNSCC through negative regulation of ATP6V1A by HIF-1α《Journal of Extracellular Vesicles》(IF=17.338)

在缺氧条件下的肿瘤细胞倾向于调节细胞外囊泡(EVs)的数量和含量,以调节肿瘤微环境(TME),从而促进肿瘤的进展。
然而,缺氧如何影响EVs分泌的机制仍有待阐明。
在这里,研究团队证实了在缺氧条件下,头颈部鳞状细胞癌(HNSCC)细胞中EVs的产生增加,其中核内体来源的EVs是受O2不足影响的主要亚型。
缺氧诱导因子-1α(HIF-1α)的积累直接下调ATP6V1A的表达,这是维持溶酶体稳态的关键。
随后,受损的溶酶体降解有助于减少多泡体(MVBs)与溶酶体的融合,并使腔内囊泡(ILVs)作为EVs的分泌。
这些发现建立了一个HIF-1α调控的溶酶体功能障碍-EV释放轴,并为更好地理解EV的生物发生提供了一个精细的框架。
外泌体起源于MVBs,这是一种包含由内吞体膜内陷形成的多个腔内囊泡(ILVs)的晚期核内体。
MVBs主要注定要与溶酶体融合,导致其含量的降解。
另外,干预其降解的机制将导致MVBs的分泌和随后的外泌体的释放。
研究表明,缺氧条件下肿瘤来源的EVs在TME重构过程和促进TME 的进展(侵袭性、血管生成、增殖、化疗和放疗抵抗、免疫逃避、代谢和癌症干细胞性等)方面发挥着重要作用。
研究表明,溶酶体相关膜蛋白(LAMPs)和组织蛋白酶D(CTSD)(一种关键的溶酶体蛋白酶)在缺氧暴露的滋养细胞中下调,最终导致溶酶体功能障碍。
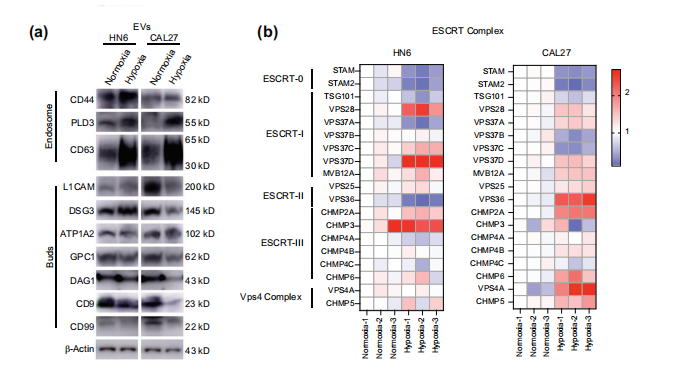
研究团队首次详细分析了为什么在HNSCC的缺氧条件下,EVs的释放会增加。
缺氧通过抑制MVBs与溶酶体的融合来增加核内体衍生的EVs的分泌,研究团队检测了Rab7与已知的溶酶体标记物LAMP1的共定位,发现缺氧可以阻止MVBs与溶酶体的融合。
缺氧主要增加了内吞体来源的EVs的分泌,这可能导致了HNSCC细胞中MVBs的溶酶体降解的破坏。
ATP6V1A的重新激活可以挽救缺氧诱导的溶酶体表型,恢复内溶酶体系统中MVB降解的溶酶体功能。
缺氧通过减少溶酶体表面 V-ATPase 成分 ATP6V1A 的表达来损害溶酶体的功能。
此外,在缺氧条件下重新表达ATP6V1A可以使溶酶体从功能障碍中恢复过来,并恢复EVs的释放水平。
接下来,研究团队试图探讨ATP6V1A下调的原因。
研究团队推测缺氧对ATP6V1A表达的调控发生在转录水平上。
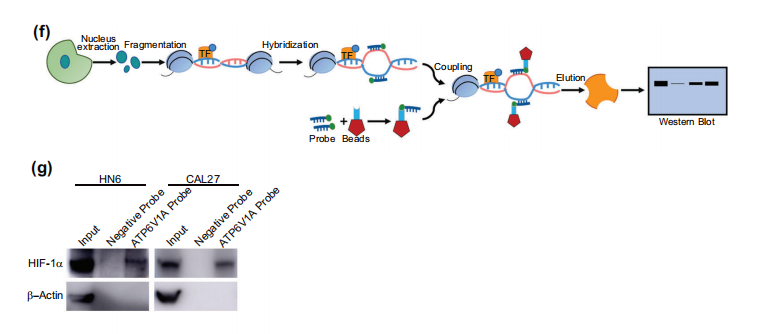
预测了与ATP6V1A启动子结合的潜在转录因子,并列出了缺氧胁迫下最重要的调控因子HIF-1α,并运用ChIP、Reverse-ChIP、荧光素酶报告基因等技术进一步研究其调控机制。
在文章中,作者使用伯信生物明星产品Reverse-ChIP试剂盒和分子探针进行调控机制研究,结果表明HIF-1α与ATP6V1A启动子结合,HIF-1α可能是ATP6V1A的转录因子,可以抑制ATP6V1A的表达。

本研究使用溶酶体的结构蛋白LAMP1来评估细胞内溶酶体的存在。
这种酸性溶酶体环境的不平衡是HNSCC细胞缺氧时损伤的主要形式,这导致了严重的溶酶体功能障碍,阐明了缺氧条件下HNSCC细胞中HIF-1α的积累可以抑制溶酶体V-ATPase的重要成分ATP6V1A的表达,从而干扰溶酶体的酸性平衡。
溶酶体功能障碍随后导致与MVBs的融合减少,最终增加EV的释放。
研究团队目前的研究揭示了溶酶体稳态和EV分泌之间平衡的一种新的调节机制。




