Positive feedback loop of c-myc/XTP6/NDH2/ NF-κB to promote malignant progression in glioblastoma
《Journal of Experimental & Clinical Cancer Research》
(IF=11.3997)
背景:
最近的研究强调了NF-κB信号通路在癌症的起始和进展中的重要作用。此外,长链非编码rna(lncRNAs)已被确定为维持NF-κB信号通路功能的关键调控因子。
尽管有这些发现,lncrna影响NF-κB通路的潜在分子机制仍在很大程度上尚未被探索。
方法:
采用生物信息学分析方法研究XTP6的差异表达和预后意义。通过体外和体内实验的方法进一步阐明了XTP6的功能作用。
为了评估XTP6和NDH2之间的相互作用,我们进行了RNA下拉和RNA免疫沉淀(RIP)分析。使用RNA纯化(ChIRP)染色质分离法检测XTP6和IκBα启动子之间的连接。
此外,采用染色质免疫沉淀(ChIP)分析c-myc与XTP6启动子的结合亲和力,为其调控机制提供见解。
结果:
XTP6在多形性胶质母细胞瘤(GBM)组织中显著上调,并与GBM患者的不良预后有关。我们的研究显示,XTP6在体内外均能促进GBM的恶性进展。
此外,XTP6通过将NDH2招募到IκBα启动子上,下调IκBα的表达,导致H3K27me3水平升高,从而降低IκBα的转录活性。
此外,c-myc介导的XTP6的上调进一步驱动了GBM的进展,与IκBα建立了一个正反馈回路,使NF-κB信号通路的激活持续下去。
值得注意的是,一种靶向NF-κB信号通路的抑制剂的应用有效地抑制了XTP6诱导的持续激活,导致体内肿瘤形成的显著减少。
结论:
结果显示,XTP6揭示了一种创新的表观遗传机制,有助于NF-κB信号通路的持续激活,为GBM的治疗提供了一个很有前途的治疗靶点。
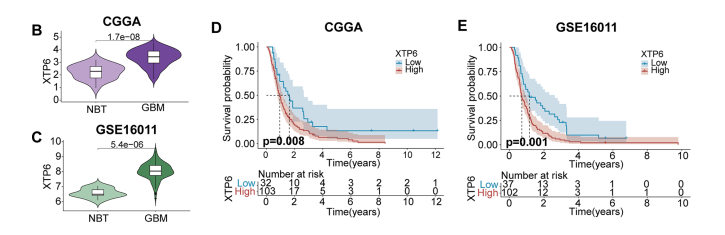
我们对XTP6的表达进行了泛癌分析。GBM组织中XTP6的表达水平明显高于相应的正常组织。在CGGA(图1B)和GSE16011数据集中,GBM中XTP6的表达水平明显高于正常脑组织(NBT)。
生存分析结果显示,在CGGA和GSE16011数据集中,XTP6高表达亚组的GBM患者的预后明显低于低XTP6表达亚组。
随后,RNA-ISH分析,发现XTP6在GBM组织中的表达水平明显高于PCTs。qRT-PCR实验分析XTP6在GBM组织中的表达水平明显高于PCTs。
XTP6在GBM细胞系中的表达量明显高于NHA细胞系,且XTP6在U251MG和U118MG中的表达量均最高。
我们的研究结果显示,在U251MG和U118MG细胞中,XTP6同时存在于细胞核和细胞质中。综上所述,XTP6是一个重要的致癌基因,与GBM的不良预后有关。

为了确定XTP6是否参与了GBM的恶性进展,我们进行了细胞功能实验。CCK-8检测结果显示,下调XTP6后,U118MG和U251MG细胞活力明显下降,而过表达U11P6导致U118MG和U251MG细胞活力均增加。
集落形成实验显示,与NC相比,XTP6基因敲除后,细胞集落显著减少。此外,U118MG和U251MG的EdU检测和U118MG细胞系均证实了这一点。
结果表明,XTP6在GBM细胞的体外增殖中起着关键作用。此外,我们的研究证实了XTP6的上调增强了GBM细胞的迁移和侵袭能力。
降低XTP6的表达显著阻碍了GBM细胞的迁移,沉默XTP6后U118MG和U251MG细胞的迁移和侵袭能力减弱。
总之,我们的研究结果表明,XTP6的上调可以了GBM细胞在体外的迁移和侵袭。
为了研究敲除XTP6是否会影响体内GBM的启动,我们利用免疫缺陷裸鼠作为体内模型。结果显示,sh-XTP6#1组和sh-XTP6#2组的裸鼠颅内肿瘤体积明显减少。
与来自sh-NC组的肿瘤样本相比,来自sh-XTP6#1组和sh-XTP6#2组的肿瘤样本中ki67阳性细胞的百分比明显降低。因此,降低XTP6的表达可以抑制体内GBM的启动。
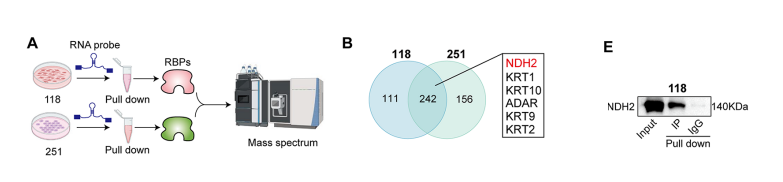
我们在U118MG和U251MG细胞系中,利用生物素化的XTP6探针进行RNA下拉实验,结果表明,在对U118MG和U251MG细胞进行的RNA下拉实验中,共鉴定出242种蛋白。
从这些蛋白中选择了6个蛋白,其中NDH2最为普遍。通过qRT-PCR发现NDH2的mRNA表达水平最高。
此外,western印迹分析证实了U118MG和U251MG细胞中XTP6和NDH2之间的关联,这是由RNA下拉实验最初提出的。
为了确定NDH2和XTP6之间的直接相互作用,我们进行了RIP检测。结果显示,在U118MG和U251MG细胞中,XTP6和NDH2之间存在显著的相关性。
然而,NDH2表达水平的降低并没有改变XTP6的表达,同样,XTP6的调节,无论是过表达还是下调,对NDH2蛋白和mRNA的表达水平没有影响。
此外,FISH和免疫染色显示XTP6和NDH2在U118MG和U251MG细胞中共定位。以上结果表明,XTP6能够与NDH2直接相互作用,但两者之间似乎没有相互调控关系。
随后,我们进行了救援实验,以研究NDH2和XTP6之间的相关性是否促进了GBM的进展。过表达XTP6表达增强了U118MG和U251MG细胞的活力,而抑制NDH2则部分减轻了这些作用。
过表达XTP6后,细胞集落数量显著增加,而
NDH2敲低则部分抵消了这些结果。此外,EdU检测表明,XTP6表达的上调可以促进细胞增殖,而NDH2的沉默部分逆转了这些作用。
我们的研究结果表明,抑制NDH2的表达可以抵消GBM细胞中XTP6水平升高所诱导的增殖影响。
此外,伤口愈合试验显示,XTP6的上调显著增强了GBM细胞的运动性,而沉默NDH2的表达则部分否定了这些增强性。
transwell检测显示,XTP6表达上调后,GBM细胞的迁移和侵袭能力增加,而NDH2表达的减少则部分减弱了这些现象。
研究结果表明,抑制NDH2的表达可以部分抵消GBM细胞中过表达诱导的增强的迁移和侵袭特性。
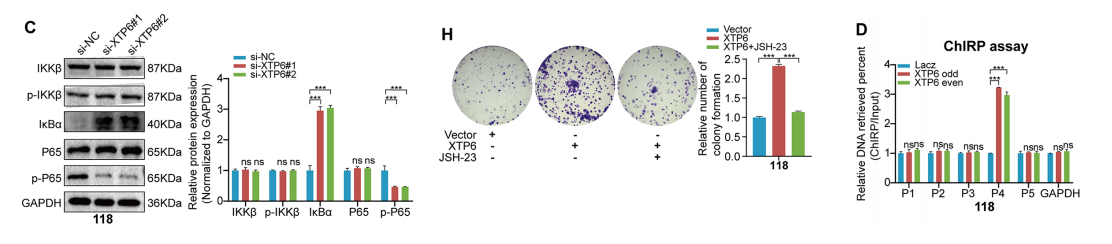
我们推测NDH2可能通过作为RNA解旋酶来激活NF-κB信号通路。在U118MG、U251MG和原代细胞中,下调导致IκBα表达升高,而XTP6过表达导致IκBα表达降低。
而无论是通过过表达还是抑制,都没有改变U118MG、U251MG和原代细胞中IKK的磷酸化水平。
结果表明,XTP6通过调节IκBα的表达,而不是通过激活IKK,来发挥其对NF-κB信号通路的调控作用。
在本研究中,我们将被称为IκBα磷酸化抑制剂的BAY 11-7085引入过表达XTP6的GBM细胞和NC细胞,以评估IκBα的表达水平。
结果表明,在U118MG、U251MG和原代细胞中,IκBα表达水平低于接受匹配空载体的细胞,提示XTP6对IκBα表达的调控主要涉及转录控制。
此外,我们还研究了XTP6是否通过激活NF-κB信号通路来影响GBM的进展。XTP6表达的上调增强了NF-κB信号通路的激活,而NF-κB抑制剂JSH- 23的应用显著抑制了XTP6触发的激活现象。
使用JSH-23抑制NF-κB信号通路,部分逆转了XTP6过表达诱导的GBM细胞的恶性进展。
研究结果表明,XTP6可以通过降低IκBα转录本的表达水平来激活NF-κB信号通路,从而促进GBM的恶性进展。
为了阐明XTP6影响IκBα表达的分子过程,我们通过生物信息学分析预测了XTP6和IκBα启动子可能的结合位点。
通过荧光素酶报告基因分析表明,转染携带−1400~-1050bp片段的质粒后,荧光素酶活性明显降低。此外,通过ChIRP检测证实了XTP6与IκBα启动子区域之间的直接相互作用。
结果表明,XTP6与−1259和−1244bp之间的IκBα启动子区域结合,表明XTP6和IκBα启动子之间形成了三重构型。
我们的研究结果表明,XTP6通过形成IκBα启动子中序列的DNA-RNA三倍来减弱IκBα的转录。
为了确定XTP6对IκBα转录活性的影响,我们构建了一个包含IκBα启动子突变的pGL4载体。荧光素酶检测结果显示,IκBα启动子中表现出明显更高的荧光素酶活性。
我们检测了NDH2是否在介导IκBα启动子上的H3K27me3中发挥了作用。在NDH2沉默后的GBM细胞中,IκBα的表达上调。
此外,ChIP检测显示,H3K27me3和EZH2水平的升高在IκBα启动子内的XTP6结合位点特异性富集,这一过程是由与NDH2的相互作用促进的。
与基因沉默相关的标记物H3K9me3水平的升高,也在IκBα启动子内相同的XTP6结合位点富集,表明NDH2存在类似的调控机制。
此外,对NDH2表达的抑制可以逆转XTP6引起的IκBα表达的减少。综上所述,XTP6通过H3K27me3依赖的方式介导IκBα表达的下调。
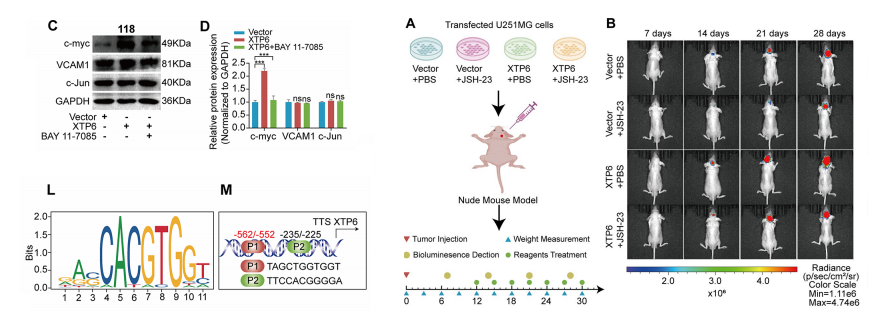
转录因子c-myc是NF-κB信号通路的重要下游因子。免疫印迹分析显示,在应用NF-κB信号通路抑制剂后,c-myc的表达明显降低。
与人工过表达XTP6的细胞相比,阻断NF-κB信号通路显著降低了c-myc的表达。XTP6的沉默显著降低了c-myc的蛋白表达。
随后,我们使用以c-myc为靶点的敲除质粒来调节c-myc的表达水平,有效地降低了其表达。c-myc的沉默并不影响P50、P65、c-Rel和RELA的表达水平。
这些发现表明,c-myc是GBM细胞中NF-κB信号通路的关键下游因子。
我们还进一步分析了c-myc表达的改变对XTP6转录表达水平的影响。c-myc的抑制导致了XTP6表达的降低,而c-myc的上调增强了XTP6在GBM细胞中的表达。
此外,对XTP6启动子的生物信息学分析发现了两个潜在的c-myc结合位点,称为P1和P2。
为了验证c-myc与XTP6启动子上的预测位点之间的相关性,我们进行了ChIP分析,表明c-myc可以直接与XTP6启动子的P1位点相互作用。
此外,荧光素酶检测结果显示,c-myc驱动的荧光素酶表达通过P1位点突变显著降低,而P2位点突变没有明显的影响。
这意味着转录因子c-myc在GBM细胞中通过P1位点与XTP6启动子相互作用。
此外,我们的研究显示,降低c-myc的表达导致了GBM细胞恶性进展的抑制,可能是由于c-myc失活对驱动GBM的致癌通路的直接负面影响。
这些结果表明,lncRNA-XTP6通过与c-myc创建一个正反馈回路,促进NF-κB信号通路的激活,从而促进GBM的恶性进展。
我们通过构建体内模型,进一步研究抑制NF-κB信号通路是否可以阻止XTP6驱动的GBM进展。在皮下肿瘤模型中,XTP6的过表达促进了肿瘤的发展,而JSH-23则显著降低了XTP6诱导的致瘤作用。
JSH- 23治疗减缓了体重减轻,并延长了携带肿瘤的小鼠的生存时间。
与PBS处理的GBM组织相比,JSH-23显著降低了过表达XTP6的GBM组织中Ki-67的表达。这些结果证实了抑制nf-κB信号通路可以抵消体内XTP6介导的GBM的进展。
综上所述,研究结果提示c-myc/XTP6/ NDH2/NF-κB正反馈回路在促进GBM的恶性进展中至关重要。
了解XTP6在GBM中的关键功能及其参与激活NF-κB信号通路,有助于加深我们对驱动GBM进展的分子机制的理解。这一见解可以为为GBM患者创造创新的治疗药物铺平道路。



 作者使用伯信生物明星产品RNA pulldown、RIP、CHIRP试剂盒以及分子探针进行了上述筛选与分子互作调控机制的研究。
作者使用伯信生物明星产品RNA pulldown、RIP、CHIRP试剂盒以及分子探针进行了上述筛选与分子互作调控机制的研究。
伯信好物推荐
RNA pulldown Kit
产品介绍:
蛋白质与RNA的相互作用是许多细胞生物学过程的核心,如蛋白质合成、mRNA 组装、病毒复制、细胞发育调控等,研究它们之间相互作用的分子机制对理解这些生物学过程非常重要。RNA pulldown技术通过体外转录标记生物素的RNA探针耦联链霉亲和素标记的磁珠,实现了对RNA结合蛋白质(RBPs)的高效富集和鉴定。
伯信RNA pulldown Kit 分为:
Bes5102(S) RNA pulldown kit 12T
Bes5102(N) RNA pulldown kit 40T
实验原理:
针对目标区域设计生物素标记的特异性RNA探针偶联磁珠,并与细胞蛋白提取物孵育,蛋白分子与RNA探针特异性结合,经洗脱,得到目的RNA探针-蛋白质复合物。最后采用Western Blot或质谱鉴定蛋白质类型。
技术流程:
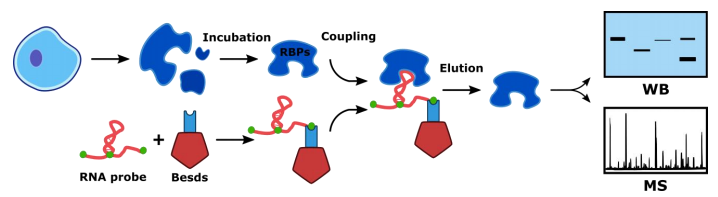
结果实例:

产品优势:
1. 自主品牌:拥有自主知识产权专利。
2. 高品质,稳定性好。
3. 精准:特异性高,背景少。
4. 易用:操作简单,容易上手。
5. 快速省时:全部实验只需3小时。
RIP Kit
产品介绍:
RNA Immunoprecipitation(RIP)是研究细胞内RNA与蛋白质结合的技术,是了解转录后调控网络动态过程的有力工具,可应用于miRNA调控靶点、RNA 与 RBPs(RNA结合蛋白)互作等研究。
伯信RIP Kit 分为:
Bes5101(S) RIP Kit 12T
Bes5101(N) RIP Kit 40T
实验原理:
RIP技术运用针对目标蛋白的抗体免疫沉淀相应的RNA-蛋白复合物,并纯化与蛋白结合的RNA。最后,结合基因特异性分析技术(PCR、qRT-PCR)或高通量分析技术(高通量测序、基因芯片),分析结合在复合物上的RNA类型及数量。
技术流程:
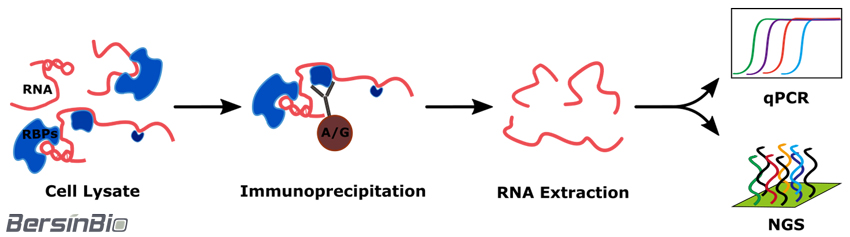
结果实例:
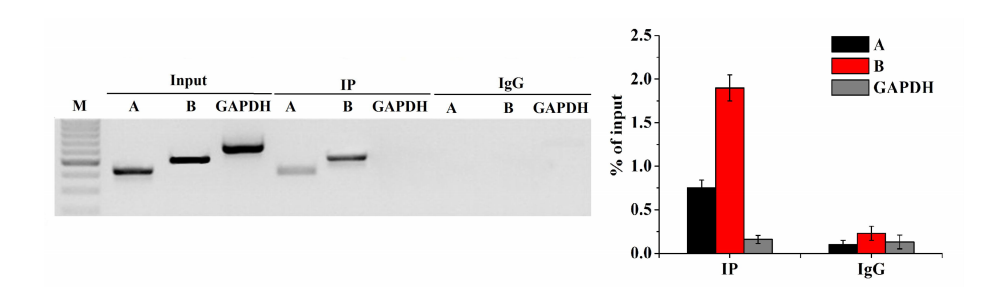
产品优势:
1. 伯信独立研发。
2. 提供优化的磁珠,适于免疫沉淀RNA-蛋白复合物。
3. 高品质,稳定性好,
4. 结果准确,重复性好。
5. 操作简单,快速省时。
CHIRP Kit
产品介绍:
ChIRP(Chromatin Isolation by RNA Purification)是一项研究RNA与DNA及蛋白质之间相互作用的技术。根据研究对象不同,ChIRP技术可分别结合高通量测序(ChIRP-Seq)和质谱技术(ChIRP-MS),研究与目标RNA互作的基因和蛋白质。

伯信CHIRP Kit 分为:
Bes5104-1(S) CHIRP-DNA Kit 12T
Bes5104-1(N) CHIRP-DNA Kit 30T
Bes5104-2(S) CHIRP-Protein Kit 12T
Bes5104-2(N) CHIRP-Protein Kit 30T
Bes5104-3(S) CHIRP-DNA、Protein Kit 12T
Bes5104-3(N) CHIRP-DNA、Protein Kit 30T
实验原理:
ChIRP方法通过设计生物素标记RNA互补探针,并使其与链霉亲和素结合,这样,在探针与目标RNA特异性结合的同时,捕获RNA结合调控的DNA染色体片段与参与转录调控的RNA结合蛋白质(RBPs)。
DNA染色体片段经过文库构建与高通量测序,在基因组水平上获得转录调控RNA(增强子RNA, eRNA)调控的下游靶基因,结合qPCR可以研究结合调控强度; RNA结合蛋白经过酶消化与高效液相-质谱分析,可以鉴定参与转录调控的蛋白质,结合Western Blot可以进一步研究结合作用强度。
技术流程:
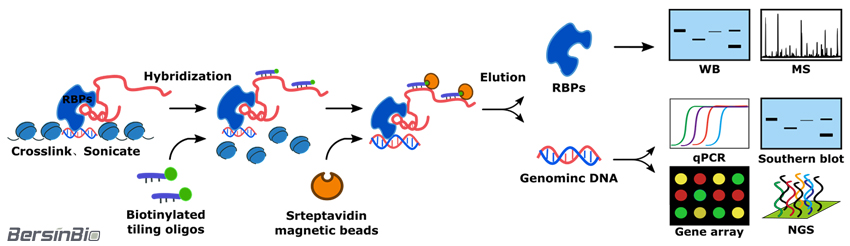
结果实例:

产品优势:
1. 伯信独立研发,具有自主知识产权。
2. 特异性和灵敏度高,稳定性好。
3. 检测方法领先,结果准确、重复性好。
4. 快速检测,操作简单,安全便捷。




