CircAKT3 promotes prostate cancer proliferation and metastasis by enhancing
the binding of RPS27A and RPL11
《Molecular Cancer》(IF=27.6999)
摘要
背景:
转移性前列腺癌(PCa)是前列腺癌患者死亡的主要原因。虽然环状rna(环状rna)被认为在肿瘤发生中起着关键作用,但它们在PCa背景下输注的特殊性尚未完全阐明。
方法:
采用RT-qPCR检测circAKT3在PCa细胞、肿瘤组织和邻近非癌组织中的表达。circAKT3的致癌作用是通过体外和体内实验的结合来确定的。
利用RNA下拉、RNA免疫沉淀(RIP)、荧光原位杂交(FISH)、免疫荧光(IF)和染色质免疫沉淀(ChIP)等方法,研究了circAKT3如何通过与RPS27A和RPL11的相互作用调节c-Myc活性。
此外,Western印迹法和进一步的体外和体内研究评估了circAKT3通过MST1对PCa进展的影响。
结果:
本研究鉴定了circAKT3在人类PCa细胞中的功能和调控,它来自于激酶-b3(AKT3)基因的外显子2到8。CircAKT3与疾病严重程度的临床指标显著相关,包括Dmico风险分类、Gleason评分和pT分期。
体外和体内实验均表明,下调circAKT3可抑制PCa细胞的增殖、迁移和侵袭。包覆si-circAKT3(LNP-si-circAKT3)的脂质纳米颗粒能有效地抑制PCa细胞形成的骨肿瘤的生长。
从机制上讲,circAKT3作为核糖体蛋白S27a(RPS27A)和核糖体蛋白L11(RPL11)之间的蛋白折叠,促进它们的细胞质易位,降低核RPL11水平,最终减少RPL11与c-Myc的相互作用,导致c-Myc驱动的巨噬细胞刺激1(MST1)表达的抑制增强。
因此,MST1的降低导致了PCa的进展和转移。CircAKT3的Alu元素和抖动(QKI)促进了RNA结合蛋白的形成。此外,RNA解旋酶URH49的下调导致circAKT3的核积累,从而抑制MST1的表达。
结论:
我们的研究表明,circAKT3作为一种蛋白折叠,促进RPS27A和RPL11之间的相互作用,从而注入c-Myc活性和PCa进展。
本研究强调了circAKT3在PCa中的关键作用及其作为阻止恶性肿瘤进展和转移的治疗靶点的潜力。
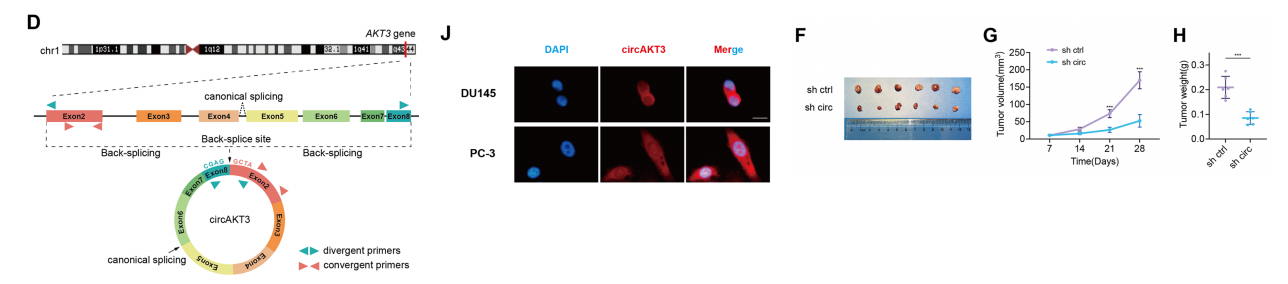
我们对PCa和ANP组织以及HM和WT PC-3细胞进行了高通量环状RNA测序。测序结果显示,与ANP和WT相比,circAKT3组织和HM PC-3细胞中circAKT3均显著上调,提示其在晚期PCa中的潜在作用。
数据库分析显示,circAKT3来源于AKT3基因的第2~第8个外显子。通过Sanger测序确定circAKT3的Te背剪接连接。凝胶电泳结果进一步验证了circAKT3的环状性质。
通过RT-qPCR和RNA-FISH检测确定亚细胞定位,表明circAKT3主要出现在细胞质中。此外,对BPH-1和多个PCa细胞系的RT-qPCR分析证实了circAKT3的上调,特别是在PCa和HM PC-3细胞中。
此外,我们分析了50例患者的ANP和PCa组织中circAKT3的表达,发现与非癌组织相比,癌组织明显升高。
我们的分析显示,circAKT3的高表达与D‘Amico风险分类、Gleason评分和pT分期呈正相关,提示circAKT3在PCa的进展中起着至关重要的作用。
我们在体外评估了circAKT3敲低对PCa细胞增殖、迁移和侵袭能力的影响。我们设计了两种针对circAKT3后剪接位点的特异性siRNA。通过CCK-8和集落形成实验评显示,下调circAKT3显著抑制了DU145、PC-3和22Rv1细胞的增殖。
下调circAKT3降低了CDK4蛋白的表达,同时增加了周期蛋白依赖性激酶抑制剂p21和p27的表达。使用Transwell和伤口愈合试验表明,circAKT3显著降低了细胞的迁移和侵袭。
我们采用了异种移植瘤模型。来自circAKT3基因敲低的细胞的肿瘤明显小于来自对照组的细胞。结果表明,下调circAKT3可显著抑制肿瘤生长。
我们构建了一个实现circAKT3过表达的质粒,尽管circAKT3水平升高,但转染的细胞中AKT3的mRNA水平保持不变,这意味着过表达circAKT3的表达并不能影响AKT3 mRNA的表达。
体外实验表明,过表达circAKT3显著增强了PCa细胞的增殖、迁移和侵袭。同样,体内实验显示,过表达circAKT3的细胞产生的肿瘤明显大于对照载体组,表明下调和过表达circAKT3分别抑制和促进了PCa细胞的增殖、迁移和侵袭。
这些研究表明,circAKT3可能在PCa进展中起到致癌驱动因素的作用。
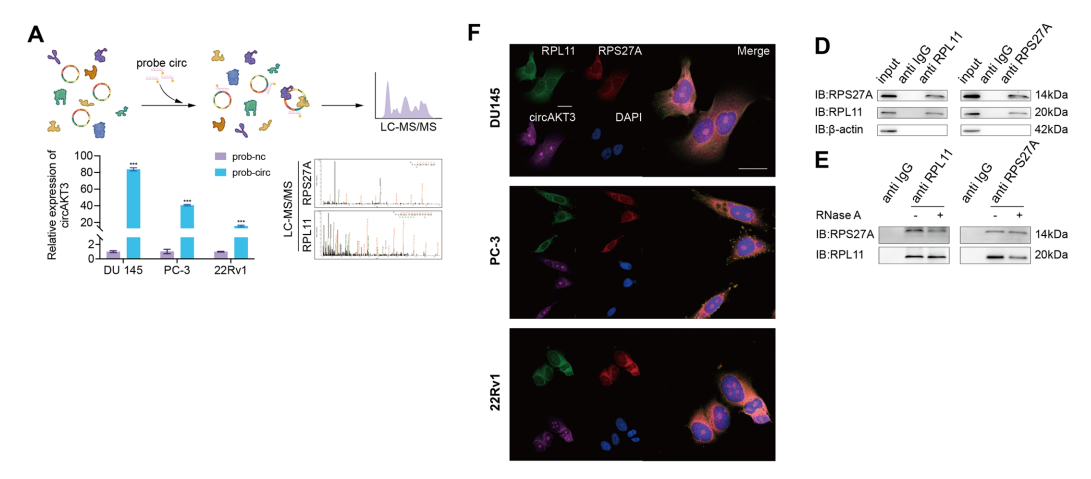
为了进一步研究circAKT3的生物学功能机制,我们采用了RNA下拉和LC-MS/MS分析,鉴定了RPS27A和RPL11的特定氨基酸序列,并结合了它们与circAKT3的相互作用。
对TCGA数据库的分析显示,PCa中RPS27A和RPL11均表达上调,提示其可能与癌症进展相关.我们进行了FISH和IF分析,清楚地显示了circAKT3与RPS27A和RPL11这些分子在细胞内的共定位。
进一步验证circAKT3、RPS27A和RPL11之间的相互作用,通过RNA下拉,然后进行蛋白印迹,提供了这些蛋白相互作用的直接证据。RIP检测证实了circAKT3与RPS27A和RPL11的特异性结合。
此外,Co-IP分析显示RPS27A和RPL11相互作用,表明形成了一个三元配合物。为了探究circAKT3在这种相互作用中的作用,我们用RNaseA处理该复合物,观察到RPS27A-RPL11相互作用减弱。
模拟图显示了circAKT3中RPS27A和RPL11的潜在结合区域,以及三元配合物的示意图。Westernblot显示,下调circAKT3后,PCa细胞中RPS27A和RPL11的核水平升高。
IF检测进一步证实了转染了circAKT3特异性sina或circAKT3过表达质粒的PCa细胞中RPS27A和RPL11的核和细胞质分布的变化,表明circAKT3调节RPS27A和RPL11的亚细胞定位,可能影响它们的细胞功能,并促进PCa的进展。
RPL11通过直接与核中的c-Myc结合来抑制c-Myc的致癌缺陷。为了研究这种相互作用,我们进行了Co-IP分析,结果表明circAKT3的下调增强了RPL11和c-Myc之间的相互作用。
此外,Co-IP实验融合了RPL11和c-Myc之间的相互作用,而RPS27A和c-Myc之间没有直接的相互作用。
这些结果表明,circAKT3通过注入RPL11-RPS27A复合物的形成,间接调节了RPL11-c-Myc的相互作用。
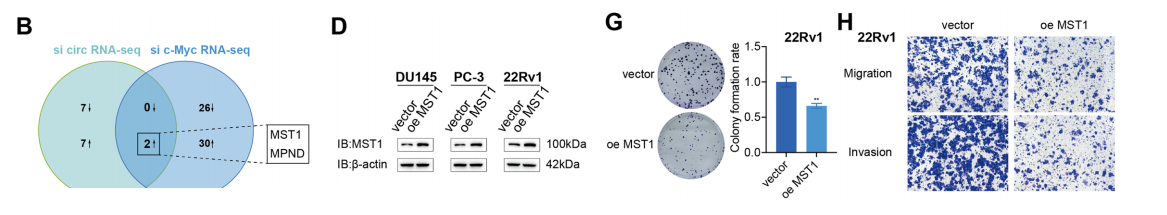
为了进一步研究circAKT3和PCa细胞中c-Myc调控的下游靶基因,我们在转染了si circAKT3或si c-Myc的细胞中进行了RNA-seq分析。
在多个PC1细胞系中,circAKT3调控的基因,包括DU145、PC-3和22Rv1。此外,研究发现,MST1在circAKT3基因下调后蛋白水平升高,而在circAKT3过表达后蛋白水平降低。
在MST1成功过表达后。采用CCK-8和集落形成实验,评价其对DU145、PC-3和22Rv1细胞增殖的影响。结果表明,过表达MST1可显著抑制PCa细胞的增殖。
此外,Transwell和伤口愈合试验表明,MST1过表达抑制了PCa细胞的迁移和侵袭能力。在使用异种移植瘤模型的体内研究中,MST1过表达组的肿瘤小于对照组(载体)组。
IHC染色图像以及肿瘤体积进展和肿瘤重量,说明过表达MST1显著抑制了肿瘤生长。在MST1基因敲除后,在体内外模型中,PCa细胞的体内外增殖均得到促进,细胞迁移和侵袭增强。
这些结果表明,MST1在PCa中起着肿瘤抑制因子的作用。我们的研究结果表明,circAKT3通过调节RPL11和c-Myc之间的相互作用来调节MST1的表达,从而促进PCa细胞的增殖、迁移和侵袭。
我们进一步探讨了c-Myc在PCa细胞中调节MST1表达的调控机制,重点鉴定了MST1启动子上潜在的c-Myc结合位点。我们采用ChIP-qPCR来评估c-Myc在预测位点之间的结合偏好。
结果表明,c-Myc可能优先结合到第三个启动子区域,称为B3。为了进一步验证B3结合位点的RT-qPCR产物的序列,我们采用Sanger测序,直接整合核苷酸序列,确保我们的fn编码的准确性。
这些结果为c-Myc通过MST1启动子上的特异性结合位点直接调控MST1提供了证据,强调了c-Myc等转录因子在基因表达调节中的关键作用。
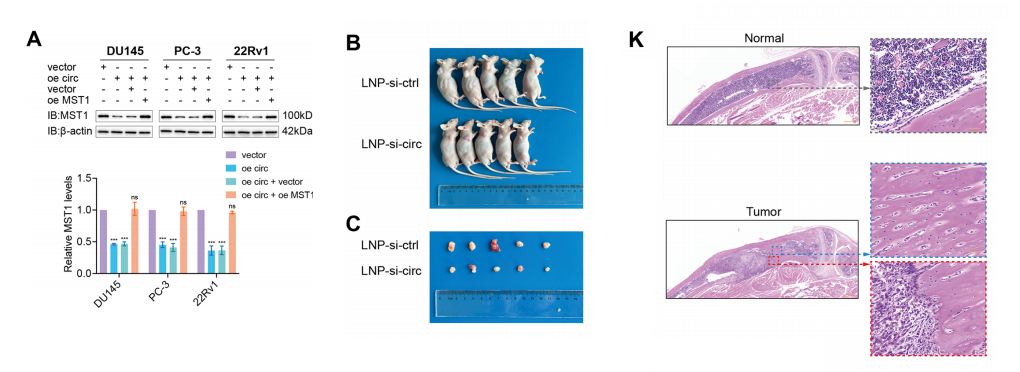
我们研究了MST1上调对过表达circakt3的PCa细胞的影响,特别是其对细胞增殖、迁移和侵袭的影响。集落形成和CCK-8检测表明,MST1逆转了circAKT3过表达对细胞增殖的影响。
Transwell试验、TEM试验和伤口愈合试验,结果表明,MST1的上调大大抵消了过表达circAKT3在PCa细胞中诱导的迁移和侵袭的增加。
体内研究证实了MST1上调对过表达circAKT3细胞增殖的影响,表明过表达MST1减轻了过表达circAKT3引起的增殖增强。
此外,我们还检测了MST1敲低在circakt3敲低的PCa细胞中被敲除的缺陷。下调MST1逆转了circAKT3下调对细胞增殖、迁移和侵袭的抑制作用。
通过LNP传递siRNA、mRNA和DNA质粒可以使体内靶向治疗,在维持治疗性有效的同时显著降低了全身毒性。
我们建立了一个小鼠肿瘤异种移植模型,并给药LNP-si-ctrl或LNP-sicircAKT3,观察到LNP-si-circAKT3显著抑制肿瘤生长。circAKT3的敲除降低了22Rv1细胞中ENZA的半抑制浓度。
我们建立了一个骨转移模型,将PCa细胞注入胫骨,以模拟PCa细胞移植后骨中的肿瘤生长。在该模型中,使用LNP-si-circAKT3治疗可导致骨内肿瘤明显缓解。这些研究提出了一种新的方法,通过结合治疗转移性前列腺癌的传递系统。
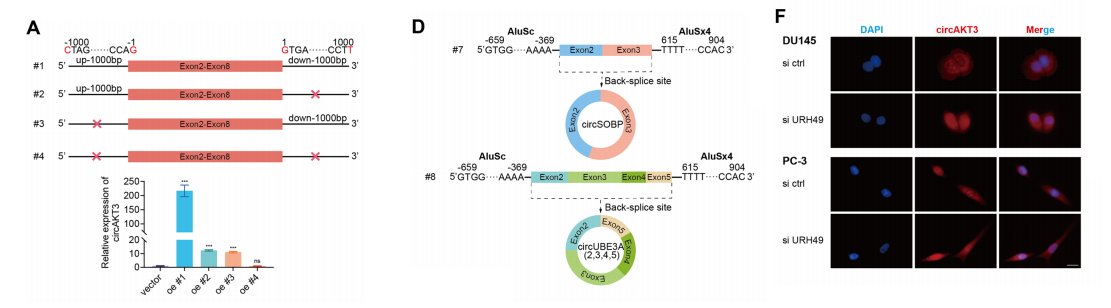
为了研究这些扇形内含子在circAKT3生成中的作用,我们设计了4个不同的质粒。研究结果表明,只有质粒#1有效地促进了circAKT3的环化,这表明该质粒中的扇形内含子在环化过程中发挥了特殊的作用。
值得注意的是,质粒#5中这些序列的缺失导致了有效的循环化,这强调了它们的重要性。进一步的实验表明,AluSc和AluSx4序列(#6)的存在,而不是整个1000 bp的扇形内含子,可能会显著增强circAKT3的生物发生。
此外,这些序列被发现可以促进其他环状rna的循环化,如circSOBP和circUBE3A。此外,在细胞核中产生的环状RNA在URH49、输出蛋白-2和Ran-GTP 等蛋白的帮助下被输出出来。
我们研究了URH49在circAKT3核输出中的作用。URH49表达的减少导致circAKT3的核水平显著升高。
此外,URH49的下调还特异性地降低了DU145和PC-3细胞中MST1 RNA的水平.这些结果表明,circAKT3的环状化是由特定的Alu序列和rna结合蛋白QKI驱动的,而其核输出则受URH49的调控。
总之,该研究表明,circAKT3在PCa中表达上调,并作为一种致癌基因。LNP-si-circAKT3抑制由PCa细胞形成的骨肿瘤的生长。
在机制上,circAKT3通过结合RPS27A和RPL11作为蛋白支架。下调CircAKT3减弱了它们的相互作用,促进了RPL11的核易位,增强了RPL11介导的c-Myc抑制,导致它们的上调MST1,最终抑制PCa细胞的增殖、迁移和侵袭。
此外,Alu序列和rna结合蛋白QKI均促进了circAKT3的循环化,而URH49介导了circAKT3的核输出。
我们的研究结果为环状rna在PCa进展中的调控机制提供了新的见解,并可能成为PCa的潜在治疗靶点。



作者使用伯信生物明星产品RNA pulldown、RIP、Co-IP试剂盒进行了上述筛选与分子互作调控机制的研究。
伯信好物推荐
RNA pulldown Kit
产品介绍:
蛋白质与RNA的相互作用是许多细胞生物学过程的核心,如蛋白质合成、mRNA 组装、病毒复制、细胞发育调控等,研究它们之间相互作用的分子机制对理解这些生物学过程非常重要。
RNA pulldown技术通过体外转录标记生物素的RNA探针耦联链霉亲和素标记的磁珠,实现了对RNA结合蛋白质(RBPs)的高效富集和鉴定。
伯信 RNA pulldown Kit分为:
Bes5102(S) RNA pulldown kit 12T
Bes5102(N) RNA pulldown kit 40T
实验原理:
针对目标区域设计生物素标记的特异性RNA探针偶联磁珠,并与细胞蛋白提取物孵育,蛋白分子与RNA探针特异性结合,经洗脱,得到目的RNA探针-蛋白质复合物。最后采用Western Blot或质谱鉴定蛋白质类型。
技术流程:
结果实例:
产品优势:
1. 自主品牌:拥有自主知识产权专利。
2. 高品质,稳定性好。
3. 精准:特异性高,背景少。
4. 易用:操作简单,容易上手。
5. 快速省时:全部实验只需3小时。
RIP Kit
产品介绍
RNA Immunoprecipitation(RIP)是研究细胞内RNA与蛋白质结合的技术,是了解转录后调控网络动态过程的有力工具,可应用于miRNA调控靶点、RNA 与 RBPs(RNA结合蛋白)互作等研究。
伯信 RIP Kit分为:
Bes5101(S) RIP Kit 12T
Bes5101(N) RIP Kit 40T
实验原理:
RIP技术运用针对目标蛋白的抗体免疫沉淀相应的RNA-蛋白复合物,并纯化与蛋白结合的RNA。最后,结合基因特异性分析技术(PCR、qRT-PCR)或高通量分析技术(高通量测序、基因芯片),分析结合在复合物上的RNA类型及数量。
技术流程:
结果实例:
产品优势:
1. 伯信独立研发。
2. 提供优化的磁珠,适于免疫沉淀RNA-蛋白复合物。
3. 高品质,稳定性好,
4. 结果准确,重复性好。
5. 操作简单,快速省时。
Co-IP Kit
产品介绍
免疫共沉淀(Co-Immunoprecipitation,Co-IP)是基于抗体和抗原之间结合的专一性用于研究蛋白质相互作用的经典方法。
伯信 Co-IP Kit分为:
Bes3011 Co-IP Kit 12T
Bes3011 Co-IP Kit 30T
实验原理:
细胞在非变性条件下被裂解时,完整细胞内存在许多蛋白质与蛋白质之间的相互作用体被保留下来,利用目标蛋白质特异性抗体免疫沉淀,沉淀得到的蛋白质复合体能够通过变性凝胶电泳分离开来,以此定性或定量分析几种蛋白质间相互作用力大小。
技术流程:
结果实例:
产品优势:
1. 伯信生物Co-IP Kit里的交联剂,可让抗体与琼脂糖珠交联,洗脱时只收集诱饵蛋白和捕获蛋白,抗体仍与珠子结合;
2. 同一个抗体既可用于免疫沉淀,又可用于WB检测;
3. 免除WB中抗体轻重链的信号干扰;
4. 操作简单、耗时短、结果客观准确;
5. 具有自主知识产权。




