The cryptic lncRNA-encoded microprotein TPM3P9 drives oncogenic RNA splicing and tumorigenesis
《Signal Transduction and Targeted Therapy》(IF=40.8000)
摘要
新出现的证据表明,先前注释为非编码的rna的隐性翻译可能产生具有致癌功能的微蛋白。然而,这些微蛋白在选择性剪接驱动的肿瘤进展中的重要性和潜在机制却很少被研究。
在这里,我们发现由lncRNA原肌球蛋白3假基因9编码的新蛋白TPM3P9通过增强致癌RNA的剪接,在透明细胞肾细胞癌(ccRCC)中表现出致癌活性。过表达TPM3P9可促进细胞增殖和肿瘤生长。
在机制上,TPM3P9与剪接因子RBM4的RRM1结构域结合,以抑制转录因子TCF7L2中RBM4介导的外显子跳跃。这导致致癌剪接变体TCF7L2-L的表达增加,该基因通过与SAM68的相互作用激活NF-κB信号通路,从而转录诱导RELB的表达。
从临床角度来看,TPM3P9在肿瘤组织中表达上调,并与TCF7L2-L和RELB的表达显著相关。
TPM3P9高表达或RBM4低表达与ccRCC患者的低生存率相关。总的来说,我们的研究结果在功能和临床上表征了“非编码RNA”衍生的微蛋白TPM3P9,从而确定了肾癌的潜在预后和治疗因素。
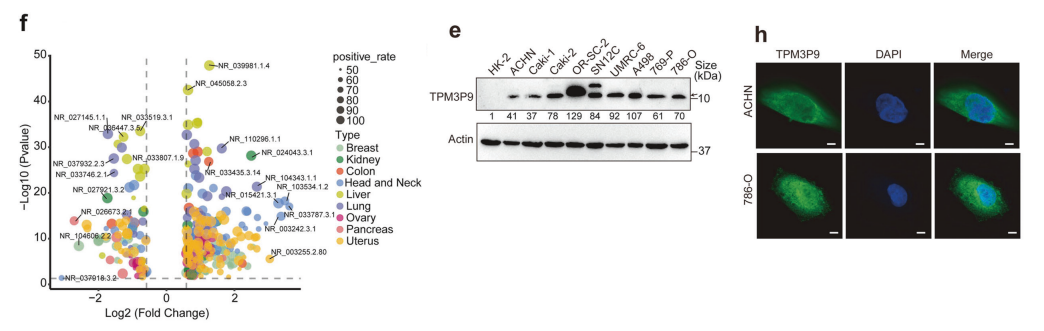
在我们之前的研究中,确定在9个癌细胞系中有3300个lncRNAs与具有主动翻译延伸的核糖体结合。
在本研究中,使用来自CPTAC、CCLE和SYSUCC数据库的蛋白质组学数据筛选候选新蛋白,我们获得了9种恶性肿瘤患者的蛋白质组学数据。
鉴定出777个lncrna编码的蛋白(LEPs),这些LEPs分布在不同的染色体上。有三种蛋白在所有检测的癌症类型中普遍表达,并且在肿瘤组织和非肿瘤组织之间有差异表达,在肿瘤组织中,lep的上调比下调更频繁。这可能表明致癌应激可诱导LEPs的表达。
此外,我们从SYSUCC中收集了58例8种实体癌患者的术后样本,发现了78个LEPs。在CPTAC队列中也发现了一些在肿瘤组织和非肿瘤组织之间的差异表达。
具体来说,与其他癌症相比,肾癌显示出显著的LEPs表达谱。这可能表明lep深入参与了肾癌的进展。
新的蛋白TPM3P9在ccRCC中表达上调,其上调与预后不良相关。为了鉴定肾癌中功能相关的新蛋白,我们对来自4个肾癌组织样本及其邻近非癌组织的蛋白进行LC-MS/MS分析。
共鉴定出7种由非编码rna编码的新蛋白。为了进一步研究ccRCC中异常调控的基因的生物学功能,我们使用sirna来评估这些LEPs对细胞增殖的影响。
结果显示,TPM3P9缺失显著抑制了ACHN细胞的增殖。在SYSUCC队列中,TPM3P9在肺癌组织中的表达低于非癌组织。
我们还通过各种实验方法证实了TPM3P9蛋白的存在。我们生成了一种针对TPM3P9的特异性抗体,并用于检测ccRCC细胞中的内源性和外源性TPM3P9蛋白。Western blot分析显示,在ccRCC细胞系和临床样本中,TPM3P9显著上调。
免疫荧光染色显示TPM3P9在ccRCC细胞中的胞质和细胞核定位。此外,我们通过核细胞质分馏实验验证了TPM3P9在细胞质和核隔室中的表达。
TCGA和CPTAC数据分析显示,TPM3P9在ccRCC组织中的mRNA和蛋白表达水平均高于相应的邻近非肿瘤组织。预后分析显示,TPM3P9高表达的ccRCC患者的总生存期(OS)和无复发生存期(RFS)较短。
总体而言,这些发现表明lncRNA-TPM3P9能够被翻译成新的微蛋白TPM3P9,该蛋白在ccRCC中异常上调,并与预后不良相关。
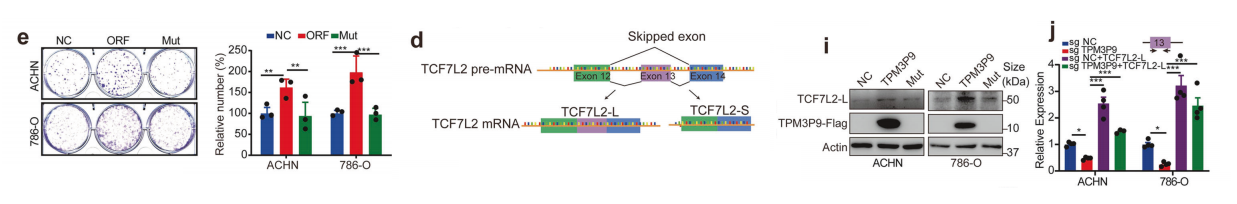
我们接下来研究了微蛋白TPM3P9对ccRCC细胞增殖的影响。我们采用CCK-8、集落形成和EdU掺入试验来评估TPM3P9蛋白过表达对细胞生长的影响。
结果表明,过表达TPM3P9蛋白,而不是相关的lncRNA,均能促进了ccRCC细胞的增殖。此外,qRT-PCR结果显示,在ACHN和786-O细胞中,lncRNA-TPM3P9的基线表达量并不显著高于肾小管上皮细胞HK-2。
这表明突变起始密码子lncRNA-TPM3P9的过表达所观察到的缺乏显著的细胞功能,并不是由于lncRNA的高基线表达。另一方面,使用sgRNAs敲除ACHN和786-O细胞中的TPM3P9。
Western blot分析证实了TPM3P9蛋白的缺失(图3g)。沉默TPM3P9可显著抑制细胞活力,抑制集落形成,减少edu阳性细胞数量,诱导g1阻滞。采用体内模型敲除TPM3P9可显著抑制肿瘤生长。
综上所述,微蛋白TPM3P9促进了ccRCC在体内和体外的进展。
TPM3P9调控致癌RNA TCF7L2的剪接探讨TPM3P9促进ccRCC的分子机制。对ccRCC蛋白质组学数据和基于TPM3P9表达的TCGA数据进行基因集合富集分析(GSEA),发现TPM3P9参与了剪接体信号转导。
与RNA剪接相关的通路在与TPM3P9共表达的蛋白中富集。我们对过表达tpm3p9的ACHN和786-O细胞进行了RNA测序分析,结果表明,外显子跳跃是与TPM3P9相关的主要RNA剪接事件。
TPM3P9的异位表达增加了TCF7L2 mRNA中第13外显子的保留,导致长剪接变体TCF7L2-L的表达增加。
过表达TPM3P9蛋白,而不是相应的mRNA,显著诱导了TCF7L2-L的表达,降低了ccRCC细胞中TCF7L2-S的表达。
在临床样本中,TPM3P9高表达与高TCF7L2-L mRNA水平显著相关。此外,TPM3P9在ccRCC细胞中的异位表达上调了TCF7L2-L蛋白的表达。沉默TPM3P9显著降低了TCF7L2-L mRNA的表达。
为了确定TPM3P9是否通过TCF7L2-L促进细胞增殖,在TPM3P9耗尽后,TCF7L2-L在ccRCC细胞中重新表达。TCF7L2-L表达的恢复逆转了TPM3P9缺失对ccRCC细胞生长的抑制作用。
沉默TCF7L2-L可抑制tpm3p9介导的细胞增殖。在体外,TCF7L2-L的过表达促进了肝癌细胞的增殖,而TCF7L2-L的下调抑制了ccRCC细胞的增殖。
此外,来自异种移植物模型的结果表明,过表达TCF7L2-L的细胞增加了异种移植物的生长,并能够消除TPM3P9敲除对肿瘤生长的抑制。
综上所述,微蛋白TPM3P9调节TCF7L2 RNA的剪接,在ccRCC细胞中产生致癌的剪接变体TCF7L2-L。
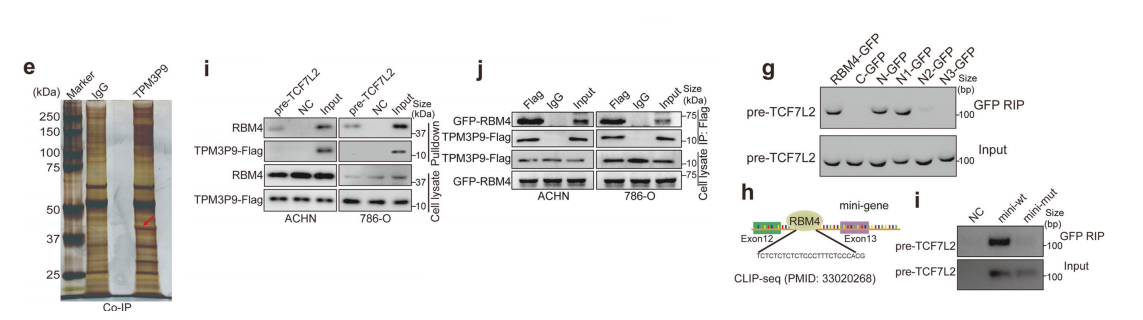
我们接下来研究了TPM3P9调控TCF7L2选择性剪接的机制。采用RNA下拉法结合高分辨率质谱法鉴定与TCF7L2 pre-mRNA结合的蛋白。
同时,我们进行了IP-MS鉴定tpm3p9相互作用的蛋白。我们将TCF7L2premrna结合蛋白与tpm3p9结合蛋白进行了比较,确定了23个重叠的候选蛋白。蛋白质相互作用网络揭示了这些候选蛋白之间的关系。
此外,通过将这些预测蛋白与23个候选蛋白相交,我们发现了5个与TPM3P9和TCF7L2 pre-mRNA相互作用的蛋白。
我们选择了参与众多基因选择性剪接的rna结合蛋白RBM4进行进一步研究。首先通过RNA下拉实验验证了RBM4与TCF7L2 premRNA的结合,证明在TCF7L2 pre-mRNA探针获得的沉淀中可以检测到RBM4而不是TPM3P9。
随后,共免疫共沉淀分析和共聚焦显微镜证实了RBM4和TPM3P9在ccRCC细胞的细胞核中的相互作用。
我们构建了编码GFP标记的全长或GFP标记的RBM4截断的质粒。将这些质粒与TPM3P9-Flag质粒共转染到ccRCC细胞中。
使用GFP或Flag特异性抗体进行的共免疫共沉淀实验显示,RBM4-GFP和RBM4-N-GFP能够与TPM3P9结合,而不能与TBM4-C-GFP结合。
我们进一步构建了表达缺乏RRM、RRM2或同时缺乏RRM1和RRM2的n端截断的质粒。N1-GFP和N3-GFP均失去了与TPM3P9结合的能力,表明RRM1结构域在RBM4-TPM3P9相互作用中发挥了关键作用。
利用RIP发现RBM4-ΔRRM1能够与TCF7L2的前mrna结合。然而,当RRM2或RRM1和RRM2结构域同时缺失时,结合TCF7L2 pre-mRNA的能力丧失。
这表明RBM4的RRM2结构域是与TCF7L2前mRNA相互作用所必需的。对RBM426的CLIP-seq数据的分析显示,TCF7L2 pre-mRNA中有特定的RBM4结合位点,表明RBM4与第13外显子上游的一个内含子交联。
利用内含子中一个突变的结合序列进行微型基因和RIP分析的结果表明,RBM4只与野生型TCF7L2 premRNA结合。
这些发现表明,TPM3P9在ccRCC细胞中通过与RBM4的相互作用来调节RNA的剪接。
我们接下来确定了RBM4在TCF7L2 RNA剪接中的作用。在过表达TPM3P9的ccRCC细胞中,外源性表达RBM4减弱了TCF7L2-L的上调。我们接下来研究了TPM3P9是否调节RBM4与TCF7L2 pre-mRNA的结合。
RIP检测显示,在TPM3P9过表达的情况下,RBM4失去了抑制TCF7L2前mrna的能力。这些结果表明,TPM3P9与RBM4的RRM结构域结合,阻断了RBM4介导的TCF7L2的RNA剪接。
我们的体外和体内实验表明,在ccRCC细胞中过表达TPM3P9可提高细胞活力,促进肿瘤生长。
裸鼠体内肿瘤样本Co-IP和western blot分析结果证实了TPM3P9与RBM4相互作用,显示TPM3P9上调了TCF7L2-L的表达,而RBM4过表达消除了这一效应。
综上所述,这些数据表明TPM3P9通过调节rbm4介导的RNA剪接来发挥其促肿瘤作用。
随后检测RBM4在ccRCC组织中的表达及其临床意义。在TCGA和SYSUCC队列中,高RBM4表达与良好的总体和无病生存率相关。免疫组化分析显示,在ccRCC患者中,TPM3P9与RBM4的表达无显著相关性。
而TPM3P9高表达和RBM4低表达的患者预后最差,而TPM3P9低表达和RBM4高表达的患者预后最好。
通过TCF7L2-L转录上调RELB激活NF-κB信号通路的转录组分析,探讨TCF7L2-L促进细胞增殖的机制ccRCC。对TCF7L2-S和TCF7L2-L转染组的比较分析显示,NF-κB通路是差异表达基因中富集的主要通路。
在转染TPM3P9的ACHN和786-O细胞中,RELB和TNFAIP3的mRNA表达水平均升高。由于RELB在NF-κB信号通路中的重要作用,我们选择RELB进行进一步研究。Western blot分析证实,在肾癌细胞中过表达TPM3P9蛋白可上调RELB的表达。
重要的是,TCF7L2-L的异位表达显著诱导了RELB的表达,而TCF7L2-S变异体的异位表达则没有显著诱导RELB的表达。
接下来,我们确定了TCF7L2-L如何转录上调RELB。使用IP-MS检测,以鉴定TCF7L2-L的共调控因子。结果显示,有27个蛋白特异性地与TCF7L2-L结合,而不与TCF7L2-S结合。
我们选择了参与NF-κB通路的致癌蛋白SAM68进行进一步研究。CoIP实验证实了TCF7L2-L与SAM68有相互作用,而TCF7L2-S没有相互作用。我们在表达TPM3P9的ccrcCC细胞中敲除TCF7L2-L或SAM68。
实验结果显示,沉默TCF7L2-L或SAM68均显著减弱了过表达TPM3P9的细胞中RELB表达的诱导。RELB启动子的DNA结合基序分析表明,TCF7L2-L有两个潜在的结合位点。
双荧光素酶报告基因分析显示,TPM3P9增加了基序No. 1的活性,而不是基序No. 2的活性,而在靶向TCF7L2-L或SAM68的siRNA处理后,这种增加强烈减弱。此外,CCK-8实验表明,TCF7L2-L、SAM68或RELB的沉默抑制了tpm3p9介导的ccRCC细胞增殖表型。
在SYSUCC队列的385个临床样本中,TPM3P9蛋白表达与TCF7L2-L、RELB和SAM68的表达显著相关,而RELB蛋白表达与TCF7L2-L和SAM68的表达呈正相关。
总之,综上所述,我们的数据表明,在ccRCC细胞中,TPM3P9通过TCF7L2-L/SAM68复合物上调RELB表达以触发NF-κB信号。
总之,我们的研究结果表明,lncrna编码的蛋白TPM3P9与RNA结合蛋白RBM4相互作用 抑制TCF7L2的外显子跳变,从而增加其表达 TCF7L2-L变异,通过与SAM68合作,转录上调RELB。我们的研究提供了一个新的,全面的分子肾癌发展的机制。
作者使用伯信生物明星产品MeRIP试剂盒进行了上述筛选与分子互作调控机制的研究。
伯信好物推荐
MeRIP试剂盒
产品介绍:
RNA甲基化指发生在RNA分子上不同位置的甲基化修饰现象,属于转录后修饰,常见的甲基化修饰方式有6-甲基腺嘌呤(N6-methyladenosine,m6A)和5-甲基胞嘧啶(C5-methylcytidine,m5C)以及7-甲基鸟嘌呤(N7-methylguanosine,m7G)等。
RNA甲基化在调控基因表达、剪接、RNA编辑、RNA稳定性、控制mRNA寿命和降解、介导环状RNA翻译等方面可能扮演重要角色。利用甲基化RNA免疫共沉淀(Methylated RNA Immunoprecipitation,MeRIP)技术,可以对RNA转录后甲基化修饰图谱进行全面研究。
伯信 MeRIP Kit分为:
Bes5203-1(S) m6A MeRIP Kit 12T
Bes5203-1(N) m6A MeRIP Kit 40T
Bes5203-2(S) m6A MeRIP Kit(含m6A抗体) 12T
Bes5203-2(N) m6A MeRIP Kit(含m6A抗体) 40T
Bes5204-1(S) m5C MeRIP Kit 12T
Bes5204-1(N) m5C MeRIP Kit 40T
Bes5204-2(S) m5C MeRIP Kit(含m5C抗体) 12T
Bes5204-2(N) m5C MeRIP Kit(含m5C抗体) 40T
Bes5205-1(S) m7G MeRIP Kit 12T
Bes5205-1(N) m7G MeRIP Kit 40T
Bes5205-2(S) m7G MeRIP Kit(含m7G抗体) 12T
Bes5205-2(N) m7G MeRIP Kit(含m7G抗体) 40T
实验原理:
MeRIP利用m5C/m6A/m7G特异性抗体识别并结合mRNA上的m5C/m6A/m7G甲基化修饰位点,以RNA免疫共沉淀方法富集甲基化修饰片段,同时,结合高通量测序与qPCR,在全转录组范围内研究发生m5C/m6A/m7G甲基化修饰的RNA区域,及其对基因表达的调控作用。
产品优势:
1. 快速省时
2. 稳定可靠
3. 配备完整




