Enhancer transcription profiling reveals an enhancer RNA—driven ferroptosis and new therapeutic opportunities in prostate cancer
(IF=40.8000)
《Signal Transduction and Targeted Therapy》
摘要
增强子RNA(eRNAs)是增强子区域转录的非编码RNA的一个亚类,已成为基因表达的关键调节因子;然而,它们在前列腺癌中的功能作用仍很大程度上未被探索。
在这项研究中,我们使用ATAC-seq和RNA-seq对二十对前列腺癌及其匹配的良性组织进行了整合染色质可及性和转录组分析。
通过结合染色质免疫沉淀测序数据,我们鉴定出一组差异表达的eRNA,这些eRNA与参与前列腺发育和致癌信号通路的基因显著相关。其中,乳铁转铁蛋白-eRNA(LTFe)在前列腺癌组织中显著下调,功能分析显示其具有肿瘤抑制作用。
机制上,LTFe通过与异质核糖核蛋白F(HNRNPF)相互作用并促进增强子-启动子染色质互作,从而促进其靶基因乳铁转铁蛋白(LTF)的转录。
此外,我们证明了LTFe-LTF轴通过调节铁转运促进铁死亡。值得注意的是,雄激素受体(AR)信号通路破坏了与LTFe相关的染色质环化,导致铁死亡抵抗。
治疗上,联合使用AR抑制剂恩杂鲁胺和铁死亡诱导剂RSL3显著抑制了肿瘤生长,为去势抵抗性前列腺癌提供了一种有前景的策略。
总之,本研究为eRNAs在前列腺癌中的机制作用提供了新的见解,强调LTFe-LTF轴是重要的表观遗传调节因子和潜在的治疗靶点,以改善治疗结果。
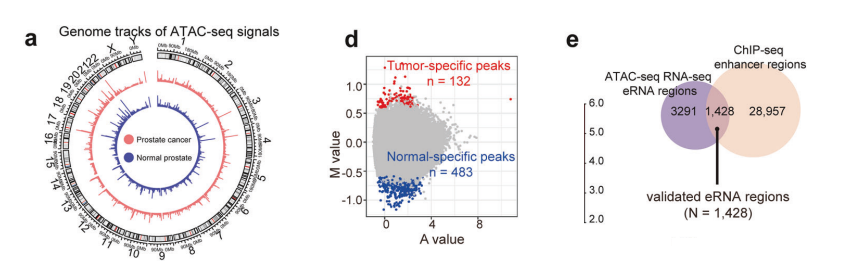
为了阐明前列腺肿瘤发生过程中染色质可及性的改变,我们对二十对前列腺癌和邻近正常前列腺组织进行了ATAC-seq和RNA-seq分析。
全基因组ATAC-seq信号图显示了癌组织与正常组织之间明显的染色质可及性模式差异,可及区域有明显的分歧。
在前列腺癌组织中产生了16,012到44,673个峰,在正常组织中则产生了13,496到47,630个峰。大量ATAC-seq信号集中在峰中心±2 kb范围内,这表明存在明确的染色质可及性结构。
接下来,我们探讨了前列腺癌发展过程中染色质可及性和基因表达之间的关系。通过标准化的ATAC-seq信号与邻近基因表达水平之间的斯皮尔曼相关性分析,确定了具有强相关性的峰(R > 0.3,p < 0.05)。
这揭示了染色质可及性和基因表达之间的重要关联,强调了它们在前列腺肿瘤发生中的相互作用。
专注于增强子区域,整合RNA测序数据后,我们纳入了三个配对的前列腺癌和邻近正常前列腺组织中的H3K27ac和H3K4me1的染色质免疫沉淀测序(ChIP-seq)数据,
差异表达分析确定了肿瘤中显著上调的98个eRNA和下调的132个eRNA。
鉴于RNA结合蛋白(RBPs)在eRNA功能中的关键作用,RBP富集分析确定了eRNA与RBPs之间的潜在相互作用,特别关注异质核糖核蛋白(HNRNP)家族成员。
总体而言,这些结果全面描述了前列腺癌中增强子驱动的转录,提供了对其表观基因组景观的重要见解,并突显了驱动肿瘤发生的潜在调控机制。
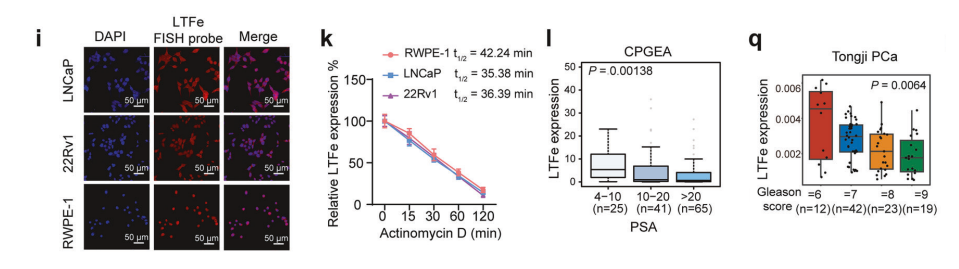
我们对eRNA表达的分析确定了一个显著的候选者,位于3号染色体46,453,226-46,459,225区域的eRNA,靠近乳铁蛋白(LTF)基因。这个eRNA,以下简称LTFe,在前列腺癌组织中与邻近的正常前列腺组织相比,显著下调。
在LTFe位点观察到ATAC-seq信号升高,表明染色质可及性增加,这是活跃调控区域的特征。ChIP-seq数据显示LTFe位于一个活跃的增强子区域内,在正常组织中H3K27ac/ H3K4me1信号富集显著高于肿瘤组织。
RNA-FISH结果表明,LTFe主要定位于细胞核,提示其在染色质水平上具有调控作用,这与其作为增强子RNA的特性一致。放线菌素D实验发现,LTFe在正常前列腺上皮细胞系RWPE-1中的半衰期较长,而前列腺癌细胞系LNCaP和22Rv1则较短。
这些发现表明,LTFe在前列腺癌细胞中的稳定性降低,可能促成了其在肿瘤环境中的失调。
我们接下来通过评估134名前列腺癌患者队列中的LTFe表达,考察了其临床意义。结果显示,较高的LTFe表达显著与较低的血清PSA水平、减少的转移和较少的阳性手术切缘相关。
较高的LTFe水平与良好的临床结果相关,包括降低BCR风险、较低的格里森评分和更早的T分期。
综合来看,我们的研究结果突显了LTFe作为前列腺癌发展潜在调节因子的作用。在癌组织中抑制LTFe可能有助于关键增强子驱动的调控元件下调。
高表达LTFe与临床预后改善,包括降低BCR风险之间存在强烈关联,这表明LTFe可以作为前列腺癌的治疗靶点和生物标志物。
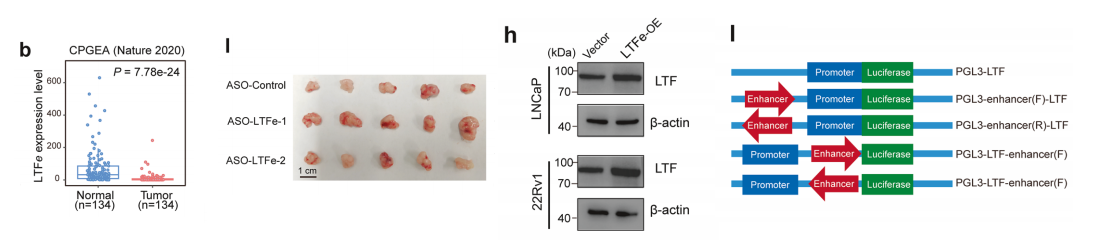
比较了肿瘤组织与邻近正常前列腺组织中LTFe的表达水平。肿瘤组织中的LTFe表达显著低于正常组织。这一发现在中国公开的前列腺癌队列中得到了验证,该队列同样表现出肿瘤中LTFe表达明显降低。
当我们分析主要由欧洲血统患者组成的TCGA PRAD队列时,并未观察到相同的差异表达模式。这种差异表明LTFe调控可能存在特定人群的差异,这可能反映了不同种族群体中前列腺癌的遗传和表观遗传差异。
与我们的组织学发现一致,LTFe表达在多种前列腺癌细胞系中普遍下调,而非恶性RWPE-1前列腺上皮细胞系则未见此现象。
这些观察结果共同表明,LTFe下调是前列腺癌中的一个反复事件,并可能在疾病进展中发挥基础作用。
为了研究LTFe下调对前列腺癌细胞行为的影响,进行了功能实验,以评估LTFe耗竭的生物学后果。CCK-8实验显示,在LTFe敲低后,前列腺癌细胞增殖显著增加。
克隆形成实验也揭示了LTFe缺陷细胞形成的克隆数量显著增加。BrdU实验证实了LTFe耗竭后癌细胞增殖能力增强。此外,我们进行了类器官实验以探讨LTFe的自主作用。
与在癌细胞中观察到的表型一致,ASO-LTFe处理显著增强了肿瘤形成类器官的能力,同时细胞增殖显著增加。
我们扩展了研究,使用异种移植模型进行了体内实验。结果显示LTFe敲低显著加速了肿瘤生长。与对照组相比,ASO-LTFe处理组的肿瘤明显更大、更重。
这些发现强烈表明,LTFe在前列腺癌中作为肿瘤抑制因子发挥作用,同时抑制细胞增殖和肿瘤生长。
我们在用针对LTFe的ASO处理的前列腺癌细胞系中进行了RNA-seq分析。考虑到eRNA通常通过顺式相互作用调节同一拓扑关联域(TAD)内的基因,我们重点关注了LTFe范围内1MB范围内的46个基因的表达变化。
其中,乳铁蛋白(LTF)是最显著受影响的基因
我们在前列腺癌细胞系中检测LTFe敲低或过表达后的LTF表达水平。
LTF的RNA和蛋白水平均随LTFe表达的变化而变化。在同济队列和TCGA队列中,LTFe与LTF表达水平呈正相关。
荧光素酶报告基因检测证实,与LTFe相关的染色质区域显著增强了LTF启动子活性,且不受方向或序列顺序的影响。值得注意的是,LTFe敲低显著降低了LTF启动子活性,而LTFe过表达则显著增强了启动子活性。
这些结果确立了LTFe作为关键增强子RNA的地位,它能够上调LTF的表达,突显其在调节前列腺癌增殖中至关重要的基因表达调控作用。
新兴证据表明,eRNA与RNA结合蛋白相互作用形成复合体,在调控基因转录中发挥关键作用。基于此,我们假设LTFe可能通过与特定的RNA结合蛋白相互作用来影响LTF的转录。
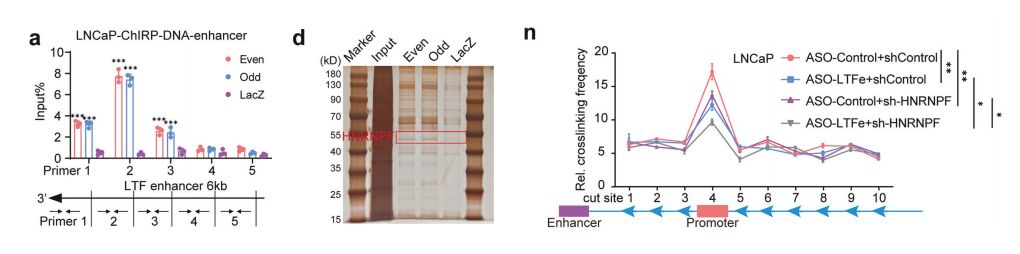
为了验证这一假设,我们采用染色质纯化RNA(ChIRP)实验,捕捉并分离前列腺癌细胞中与LTFe相关的RNA结合蛋白和基因组区域。
我们首先通过使用针对LTFe的生物素标记反义探针验证了ChIRP检测的特异性。
后续分析发现,与LTF增强子(chr3:46,454,426-46,455,625)和启动子区域(chr3:46,485,234-46,485,734)相对应的DNA片段显著富集,表明LTFe直接与这些基因组区域相互作用以调控LTF表达。
我们分析了LTFe探针富集的蛋白质。银染显示,在探针组中与对照组相比,40 kDa到55 kDa之间存在明显的蛋白质条带。
质谱分析确定了异质核糖核蛋白F(HNRNPF),一种46 kDa的蛋白质,在LTFe相关组分中特异性富集。
通过western印迹进一步验证了LTFe与HNRNPF之间的相互作用,证实了探针组中HNRNPF的富集而对照组中则没有。
我们进行了RIP-qPCR。结果表明,HNRNPF在LTFe区域3的结合尤为强烈。在HNRNPF敲低后,这种结合显著减少,证实了相互作用的特异性。
我们观察到HNRNPF和LTF的表达水平之间存在正相关,表明HNRNPF可能通过与LTFe相互作用直接调节LTF的表达。
HNRNPF敲低后,LTF的RNA和蛋白水平均显著降低,进一步证实了HNRNPF是LTF表达的关键调控因子。
此外,我们发现HNRNPF能够结合到LTF增强子(引物2)和启动子(引物4)内的特定区域,结合强度受HNRNPF和LTFe表达水平的调节。
这表明两种分子在调节LTF转录方面存在协同效应。qRT-PCR和双荧光素酶报告基因检测,证明HNRNPF过表达可以逆转LTFe敲低导致的LTF表达和启动子活性下降。
这些结果进一步支持了HNRNPF和LTFe在增强LTF转录中的合作作用。
为了研究LTF启动子与其增强子之间的直接染色质相互作用,我们在LNCaP·和22Rv1细胞中进行了染色体构象捕获(3C)实验。
数据提供了强有力的证据,表明LTF增强子与启动子之间存在显著的物理相互作用,这些位点的相互作用频率明显高于相邻基因组区域。这些结果表明,所鉴定的增强子正在积极地与启动子结合,以调控LTF转录。
当同时敲低LTFe和HNRNPF时,相互作用频率的减少最为明显,这表明它们在促进LTF转录所需的染色质环形成中具有协同作用。综合来看,这些发现表明LTFe和HNRNPF通过增强关键基因组区域之间的染色质环形成来协同调控LTF转录。
LTFe和HNRNPF之间的这种相互作用突显了eRNA和RBPs在通过染色质结构调节基因表达中的关键作用,为推动前列腺癌进展的分子机制提供了重要见解。
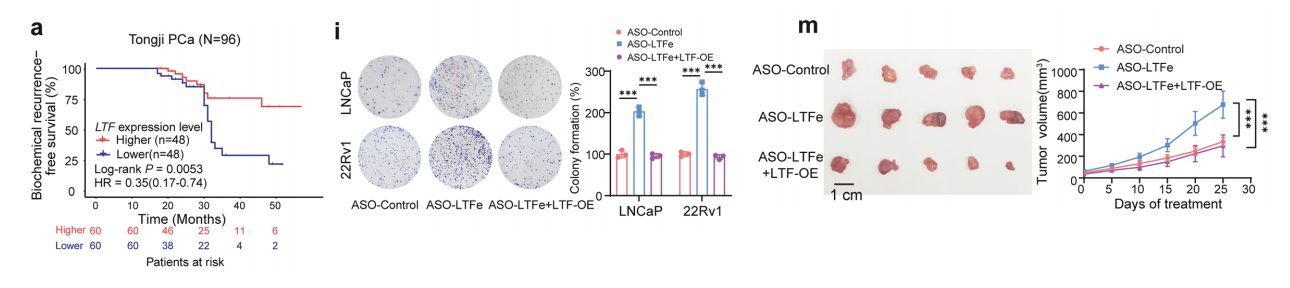
我们假设LTFe的抗肿瘤作用主要通过上调LTF表达来实现。我们首先分析了LTF表达对前列腺癌增殖的影响。高LTF表达与前列腺癌患者BCR风险降低之间存在强烈关联。
相反,低LTF表达则显著与侵袭性疾病特征相关,如更高的格里森评分和更晚期的T分期。此外,前列腺癌组织中的LTF表达明显低于邻近的非癌组织。
接下来,我们生成了过表达LTF的细胞。LTF的过表达显著降低了癌细胞的增殖。升高的LTF表达对前列腺癌的增殖产生了多种抑制作用。这些发现突显了LTF作为前列腺癌发展关键抑制因子的潜在作用。
为了进一步评估前列腺癌增殖过程中LTFe与LTF之间的顺式调控关系,我们在LNCaP和22Rv1细胞中进行了挽救实验。
敲低LTFe导致显著的促肿瘤变化,包括细胞增殖增强、克隆形成增加、细胞周期向S期偏移、BrdU摄取升高以及体内肿瘤生长加速。
重要的是,这些促肿瘤效应完全被LTF过表达逆转,强调了LTFe与LTF之间的调控相互作用。这些结果证明LTF在抑制前列腺癌增殖中起着关键作用。
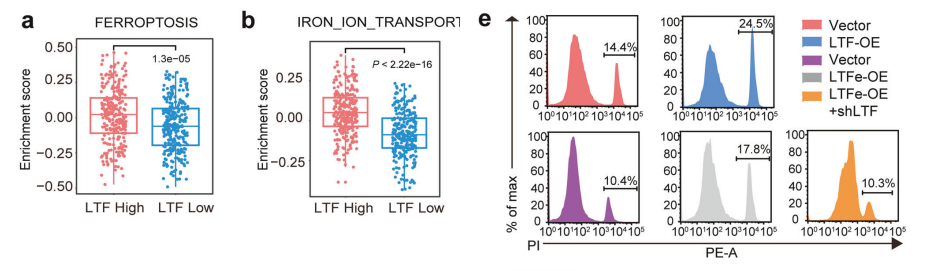
我们研究了LTF在前列腺癌进展中的作用,特别是通过铁死亡机制。基因集变异分析(GSVA)显示LTF表达与铁相关通路之间存在强烈关联,高LTF表达与通路富集分数增加相关,表明LTF在促进前列腺癌细胞铁死亡中起关键作用。
我们使用了多种细胞死亡途径的抑制剂。只有铁死亡抑制剂铁蛋白-1(Fer-1)能够恢复因LTF或LTFe过表达而降低的细胞活力。其他针对凋亡(ZVAD-fmk)、自噬(SAR405)、坏死(Necro-1)和半胱天冬酶-1(Belnacasan)的抑制剂均无效果。
这些结果表明,LTF或LTFe引起的细胞活力下降是通过铁死亡特异性介导的,排除了其他程序性细胞死亡途径。
LTF过表达导致前列腺癌细胞中脂质活性氧(LipROS)显著增加,这是铁死亡的一个重要特征。由于LTFe过表达引起的LipROS增加被LTF敲低所逆转,证实了LTF是LTFe诱导铁死亡的关键介质。
同样,LTFe过表达引起的细胞死亡通过减少LTF得到缓解,进一步支持了LTF在介导由LTFe触发的铁死亡中的关键作用。
我们使用选择性铁死亡诱导剂RSL3处理后,过表达LTF或LTFe的细胞死亡显著增加。这伴随着丙二醛(MDA)水平的升高,后者是脂质过氧化的关键指标,进一步验证了铁死亡是其作用机制。
此外,过表达LTFe或LTF增加了细胞内Fe2+水平,这些变化在RSL3处理下进一步放大。我们的研究结果表明,LTFe-LTF轴通过调节铁转运并增强对如RSL3等铁死亡诱导剂的敏感性,在前列腺癌细胞中促进铁死亡。
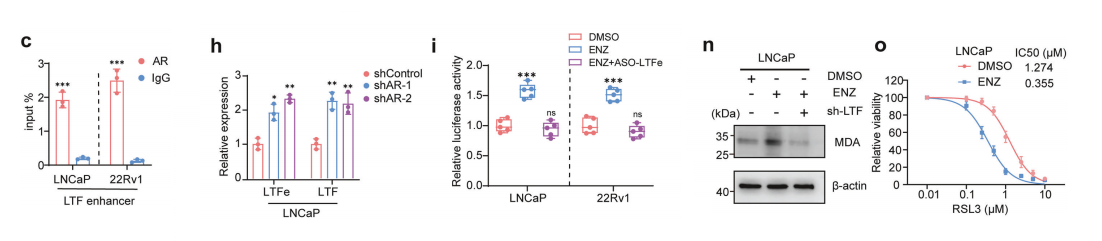
我们研究了AR是否通过调控LTFe-LTF轴影响铁死亡。我们首先分析了AR与LTF之间的调控关系,通过检查LTF基因增强子和启动子区域中的雄激素反应元件(AREs)。
利用ChIP-seq数据集,我们发现这些位点存在显著的AR结合,表明AR直接调控LTFeLTF轴。这一结论进一步通过ChIP-qPCR得到证实,验证了AR与这些AREs的结合。
对多个前列腺癌队列的分析,均显示AR表达与LTFe和LTF表达之间存在显著负相关。此外,AR扩增样本中LTF表达显著降低,表明AR抑制LTFe-LTF表达,可能通过抑制铁死亡来发挥作用。
为了探讨AR抑制是否能逆转这一效应,我们用抗AR药物enzalutamide(ENZ)处理了前列腺癌细胞,这导致LTFe和LTF表达显著上调。双荧光素酶实验显示,ENZ处理增加了LTF启动子活性,这种增加依赖于LTFe的表达,因为敲低LTFe逆转了这一效应。
此外,3C实验揭示了ENZ处理后LTF增强子与启动子之间的染色质环化增强,进一步促进了LTF的转录。
ENZ处理显著增加了LipROS水平,这一效应被LTF敲低所逆转,表明LTF是ENZ诱导的铁死亡的关键介质。
此外,ENZ处理还增加了其他铁死亡标志物,包括Fe2+含量、丙二醛(MDA)水平和细胞死亡率,这些指标均被LTF敲低所减弱。
重要的是,ENZ处理增强了前列腺癌细胞对RSL3的敏感性,RSL3是一种选择性的铁死亡诱导剂,这表明AR抑制增强了铁死亡。有趣的是,RSL3还使22Rv1细胞重新对ENZ处理敏感,突显了双向协同效应。
我们的结果表明AR信号通过下调LTFe-LTF轴抑制铁死亡,靶向AR可增强前列腺癌细胞的铁死亡,特别是对传统治疗耐药的病例。
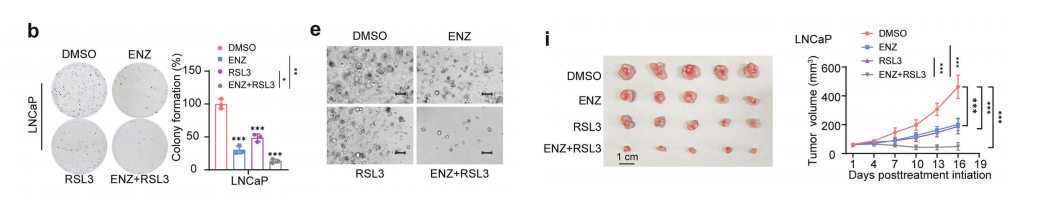
鉴于我们先前的研究发现,AR抑制通过LTFe-LTF轴增强对铁死亡的敏感性,我们研究了将RSL3与AR联合使用是否能进一步提高疗效。拮抗剂ENZ可以为激素敏感性前列腺癌(HSPC)和CRPC提供更有效的治疗方法。
为进一步研究,我们评估了RSL3和ENZ单独使用及联合使用对前列腺癌细胞系的影响。LNCaP细胞作为HSPC模型,而22Rv1代表CRPC。单独使用RSL3显著抑制了两种细胞系的细胞增殖和克隆形成。
RSL3与ENZ的联合使用表现出协同效应,导致细胞增殖和克隆形成的显著减少,比单独使用任一药物的效果更为明显。这种协同效应在CRPC 22Rv1细胞中尤为显著,这些细胞对ENZ单药治疗具有抗性,但对联合治疗反应强烈,表明ENZ使CRPC细胞对铁死亡敏感。
为了进一步验证这些发现,我们进行了患者来源的类器官实验。与我们在细胞系中的观察结果相似,RSL3和ENZ的组合显著减少了类器官的生长,优于单独使用任一药物。
这一发现强调了将铁死亡诱导剂与AR靶向剂联合使用以改善前列腺癌治疗效果的潜在转化意义。
我们在免疫缺陷小鼠中建立了LNCaP(HSPC)和22Rv1(CRPC)异种移植模型。与我们的体外研究结果一致,联合疗法相比单独使用RSL3或ENZ,显著减少了肿瘤的生长。此外,安全性和耐受性评估显示,未发现影响健康器官的毒性(补充图9c,d)。
重要的是,联合疗法在CRPC异种移植模型中尤为有效,该模型以其对标准AR靶向疗法的耐药性而闻名。
接受RSL3和ENZ联合治疗的肿瘤显示出最大的生长抑制,表明这种方案可能克服晚期前列腺癌中的耐药机制。
总之,我们的研究揭示了LTFeLTF轴在前列腺癌中的关键作用,并提供了一个机制框架,以理解增强子RNA如何调控铁死亡和肿瘤抑制。
通过证明AR抑制可以恢复LTFe和LTF活性,我们提出了一种新的治疗策略,将AR抑制剂与铁死亡诱导剂结合使用,有效治疗CRPC。ENZ和RSL3的组合显示出巨大的潜力,有望克服耐药性和改善临床结果,值得进一步的临床试验研究。

作者使用伯信生物明星产品ChIRP试剂盒进行了上述筛选与分子互作调控机制的研究。
ChIRP Kit
产品介绍
ChIRP(Chromatin Isolation by RNA Purification)是一项研究RNA与DNA及蛋白质之间相互作用的技术。
根据研究对象不同,ChIRP技术可分别结合高通量测序(ChIRP-Seq)和质谱技术(ChIRP-MS),研究与目标RNA互作的基因和蛋白质。
伯信 ChIRP Kit分为:
Bes5104-1(S) ChIRP-DNA Kit 12T
Bes5104-1(N) ChIRP-DNA Kit 30T
Bes5104-2(S) ChIRP-Protein Kit 12T
Bes5104-2(N) ChIRP-Protein Kit 30T
Bes5104-3(S) ChIRP-DNA、Protein Kit 12T
Bes5104-3(N) ChIRP-DNA、Protein Kit 30T
实验原理:
ChIRP方法通过设计生物素标记RNA互补探针,并使其与链霉亲和素结合,这样,在探针与目标RNA特异性结合的同时,捕获RNA结合调控的DNA染色体片段与参与转录调控的RNA结合蛋白质(RBPs)。
DNA染色体片段经过文库构建与高通量测序,在基因组水平上获得转录调控RNA(增强子RNA, eRNA)调控的下游靶基因,结合qPCR可以研究结合调控强度。
RNA结合蛋白经过酶消化与高效液相-质谱分析,可以鉴定参与转录调控的蛋白质,结合Western Blot可以进一步研究结合作用强度。
技术流程:
结果实例:
产品优势:
1. 伯信独立研发,具有自主知识产权。
2. 特异性和灵敏度高,稳定性好。
3. 检测方法领先,结果准确、重复性好。
4. 快速检测,操作简单,安全便捷。




