Lung metastasis and recurrence is mitigated by CAR macrophages, in-situ-generated from mRNA delivered by small extracellular vesicles
(IF=15.7001)《Nature Communications》
摘要
癌症转移与复发仍是导致癌症相关死亡的主要原因,而肺部是主要的转移解剖部位。嵌合抗原受体巨噬细胞(CAR-M)因其卓越的肿瘤浸润能力、抗原特异性吞噬功能以及作为专职抗原呈递细胞的特性,成为极具前景的癌症治疗候选方案。
然而,CAR-M疗法的广泛应用仍面临诸多挑战,包括制造工艺复杂以及静脉给药后主要在肝脏积聚等问题。
本研究开发了一种可吸入式工程化小细胞外囊泡(sEV),其装载了间皮素特异性嵌合抗原受体信使RNA(CARmRNA@aCD206 sEVs),可在体内原位生成CAR-M细胞。
该囊泡表面整合了抗CD206单链可变区片段(scFv),能够靶向表达CD206的免疫抑制性(M2表型)巨噬细胞。
小鼠模型研究结果表明,吸入式CARmRNA@aCD206 sEVs能够在肺组织中富集,并特异性向巨噬细胞递送CAR mRNA,促进原位CAR-M细胞的生成。
在肺转移瘤模型中,吸入式CARmRNA@aCD206 sEVs能有效抑制肿瘤生长并建立长期记忆免疫,从而预防肿瘤复发。
综合而言,我们设计的sEV递送平台展现出选择性向肺组织巨噬细胞递送CAR mRNA的能力,通过原位生成CAR-M细胞,为有效对抗肺转移瘤和预防复发提供了一种前景广阔的免疫治疗策略。
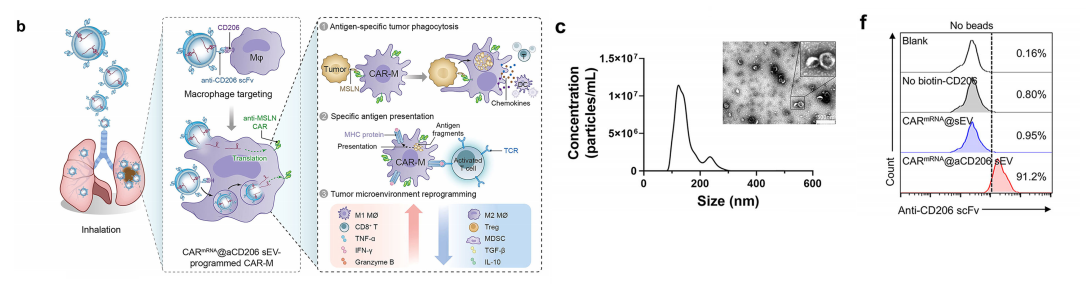
为实现CAR-M细胞在肺转移癌病灶的原位生成,我们首先开发了能特异性向巨噬细胞递送CAR mRNA的sEVs载体。我们通过基因融合技术将RNA结合蛋白L7Ae与CD63蛋白耦联,构建了CD63-L7Ae融合体。
为实现巨噬细胞选择性靶向,我们将抗CD206单链抗体与跨膜蛋白LAMP2进行基因融合,构建出抗CD206-LAMP2载体。
随后,将抗CD206-LAMP2、CD63-L7Ae-P2A-Cx43 S368A以及抗MSLN CAR-C/D盒mRNA慢病毒质粒与辅助质粒共转染至HEK 293T细胞中,用以生产编码相应基因的慢病毒。
为确保不同组别间mRNA在sEVs中的负载量一致,我们采用qPCR和DNA FISH技术对已建立的单克隆细胞系中靶区基因的整合情况进行了定量分析。
结果共同表明,我们筛选出的三株能产生携带CAR mRNA的EVs的单克隆293T细胞,其CAR mRNA表达框的载体拷贝数(VCN)。
我们采用TEM观察了CARmRNA@aCD206 sEVs在EVs缺失血清中的形态随时间变化情况。
这些评估表明,CARmRNA@aCD206 sEVs的粒径和形态在5天内保持基本稳定,证实其在血清中具有优异的稳定性。
此外,通过蛋白质印迹分析证实了CARmRNA@aCD206小细胞外囊泡(sEVs)中sEV标志物(HSP70、CD63、TSG101、CD9)的表达,且无细胞污染物(钙联蛋白)存在。
为验证基因修饰成功,我们采用蛋白质印迹法检测了细胞裂解液和sEVs中工程化蛋白的表达。结果显示,CARmRNA@aCD206 sEVs中可检测到抗CD206单链抗体(scFv)与L7Ae融合蛋白的强表达。
流式细胞术证实了CARmRNA@aCD206 sEVs表面显著展示的 抗CD206单链抗体片段(scFv),其抗原结合域保持了正确的外向取向。
我们改造了293T细胞使其分泌LAMP2-mCherry标记的小型EV(sEVs)、CD63-GFP标记的sEVs以及LAMP2/mCherry-CD63/GFP复合标记的sEVs。
通过超滤尺寸排阻色谱(UF-SEC)纯化这些sEVs后,我们采用共聚焦显微镜技术对荧光信号的共定位情况进行了观测。表明纯化后囊泡保持完整且分散良好。
共表达LAMP2-mCherry和CD63-GFP的细胞来源的小胞外囊泡中约72%呈现双荧光信号,提示LAMP2与CD63在同一个囊泡内共定位的可能性较高。
该发现支持了将CAR mRNA与CD206-scFv同时装载至单个小胞外囊泡的可行性,从而提升CAR mRNA的靶向递送效率。
为探究mRNA装载至sEVs的分子机制,我们构建了以下特异性修饰的对照组;实时定量PCR分析显示,CARmRNA@aCD206小细胞外囊泡中的嵌合抗原受体mRNA含量显著高于其他组别,这表明L7Ae与C/D盒的共表达对于将mRNA有效装载入小细胞外囊泡至关重要。
先前研究表明,sEV膜能保护内部mRNA免受细胞外核糖核酸酶降解。我们通过用RNase A消化CARmRNA@aCD206 sEVs并分析CAR mRNA水平验证了这一保护效应。
单独使用RNase A处理时,CARmRNA@aCD206 sEVs中的CAR mRNA丰度未受影响;但若在RNase A孵育前先用Triton X-100破坏膜结构,则会导致CAR mRNA显著降解。
这些结果共同证实,我们成功制备出了表面修饰抗CD206单链抗体、内部装载CAR mRNA的工程化sEVs。
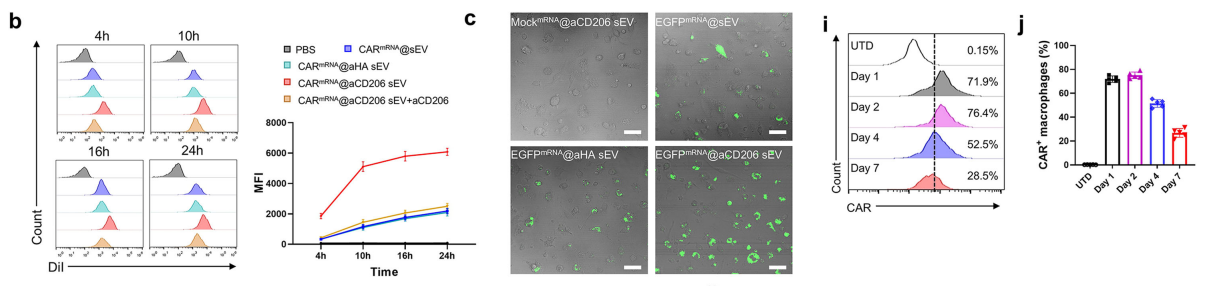
为评估骨髓源性巨噬细胞(BMDMs)对DiI标记的小胞外囊泡(sEVs)的摄取情况,我们将sEVs与M2型BMDMs共培养,并分别在4小时和24小时通过共聚焦显微镜观察其内化过程。
此外,我们将CARmRNA@aCD206 sEVs上的抗CD206单链抗体(scFv)替换为非靶向scFv(抗HA标签scFv),构建了CARmRNA@aHA sEVs,用以验证CARmRNA@aCD206 sEVs的靶向特异性。
结果显示,在4小时和24小时两个时间点,M2型BMDMs对CARmRNA@aCD206 sEVs的内化程度均显著高于非靶向的CARmRNA@sEVs或CARmRNA@aHA sEVs。
此外,抗CD206抗体的存在有效抑制了巨噬细胞对CARmRNA@aCD206 sEVs的内化作用,这证实了CD206在介导M2型巨噬细胞靶向递送中的关键作用。
为进一步量化sEV摄取的动力学特征,我们在多个时间点进行了流式细胞术分析,研究发现CARmRNA@aCD206 sEVs的摄取量随时间推移持续增加,而CARmRNA@aCD206 Exo组中sEVs的摄取效率在10小时后开始逐渐下降。
CARmRNA@aCD206 sEVs摄取增强可归因于其与巨噬细胞表面CD206受体的特异性结合,从而促进更高效的内化过程。
这些结果表明,抗CD206单链抗体工程化改造成功赋予了sEVs靶向递送巨噬细胞的能力,使CAR mRNA得以进入细胞进行翻译。
作为概念验证,我们构建了EGFP mRNA报告系统(EGFPmRNA@aCD206 sEV),并在处理后的M2型骨髓源性巨噬细胞(BMDMs)中观察到显著的EGFP表达,证实了sEV mRNA递送与翻译的成功。
此外,通过流式细胞术评估CARmRNA@aCD206 sEV处理的BMDMs中CAR蛋白表达,结果显示平均73%的巨噬细胞存在CAR表达。
使用CHX处理后,CAR阳性巨噬细胞比例显著下降,表明CAR蛋白主要由CARmRNA@aCD206 sEV递送的CAR mRNA翻译产生。
在CARmRNA@aCD206 sEV+CHX处理组的BMDMs中,仍可检测到CAR蛋白水平,这种残留的CAR蛋白可能部分源于CAR mRNA翻译的不完全抑制,同时也存在部分CAR蛋白直接从sEV膜转移至巨噬细胞膜的可能性。
为评估抗CD206单链抗体(scFv)与Cx43 S368A对mRNA递送效率的贡献,我们制备了四种载有Nanoluc mRNA的小胞外囊泡(sEVs)。
与未经处理的sEVs相比,表达Cx43 S368A、抗CD206 scFv或双组分的sEVs处理的M2 BMDMs中,Nanoluc蛋白荧光强度分别提升5.7倍、4.2倍和18.4倍。
这些结果表明,尽管效果不及文献56-59报道的水泡性口炎病毒糖蛋白(VSV-G),但Cx43 S368A与抗CD206 scFv均能显著提高mRNA递送效率。鉴于大多数抗体的等电点超过8,抗CD206 scFv在酸性内体环境中会携带正电荷。
这种正电荷可以增强sEV与带负电的内体膜磷脂之间的相互作用,使膜结构失稳并促进mRNA释放到细胞质中。然而,这一假设机制仍需进一步的实验验证。
此外,随着sEVs浓度的增加,CARmRNA@aCD206 sEV介导的CAR-M生成比例呈现浓度依赖性上升。
值得关注的是,CARmRNA@aCD206 sEVs引发的CAR表达具有瞬时性特征——48小时达到峰值后随天数增加逐渐衰减,这与mRNA缺乏基因组整合的特性相符。
这些结果共同证明:CARmRNA@aCD206 sEVs能高效递送CAR mRNA至M2型骨髓源性巨噬细胞,并诱导CAR蛋白的瞬时表达。
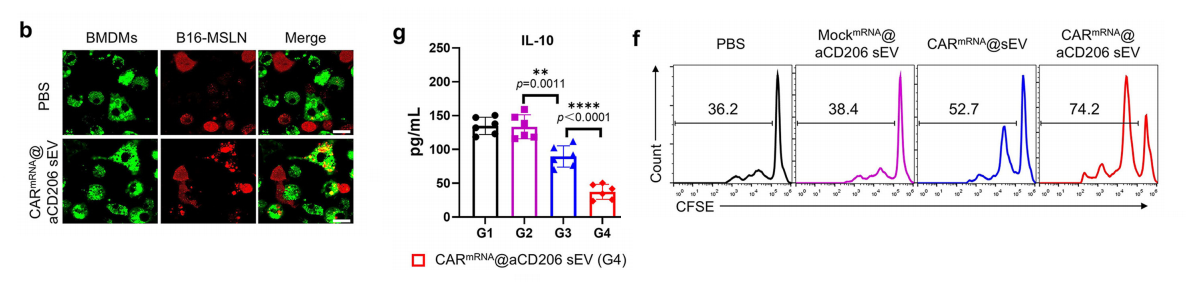
为研究CAR介导的抗原特异性肿瘤吞噬作用,我们构建了稳定过表达CAR靶标间皮素(mesothelin)的B16细胞系。
将经PBS、MockmRNA@aCD206 sEVs、CARmRNA@sEVs或CARmRNA@aCD206 sEVs预处理的M2型骨髓源性巨噬细胞,与CFSE标记的亲代B16细胞(MSLN-)或B16-MSLN细胞(MSLN+)共培养后,通过流式细胞术检测吞噬活性。
经CARmRNA@aCD206 sEV处理的M2型骨髓源性巨噬细胞(BMDMs)对B16-MSLN肿瘤细胞表现出显著的抗原特异性吞噬功能增强。
共聚焦显微镜显示,CARmRNA@aCD206 sEV组中BMDMs与MSLN+靶区细胞存在广泛共定位,进一步验证了吞噬效能的提升。
接下来,我们通过基于荧光素酶的细胞毒性实验评估了经处理的M2型骨髓源性巨噬细胞(BMDMs)对肿瘤细胞的抗原特异性杀伤作用。
结果显示,经CARmRNA@aCD206 sEV处理的M2 BMDMs能选择性增强B16-MSLN细胞(而非B16细胞)的死亡,且呈现剂量依赖性,证实其获得了抗原特异性抗肿瘤细胞溶解能力。
此外,我们还检测了与B16-MSLN或B16细胞共培养后,不同处理组分泌的细胞因子水平。ELISA分析表明,当与B16-MSLN黑色素瘤细胞共孵育时,CARmRNA@aCD206 sEVs处理能选择性增强IFN-γ和TNF-α的分泌。
与此同时,该处理在B16-MSLN细胞存在时有效抑制了免疫抑制性细胞因子白细胞介素-10(IL-10)的产生,而亲代B16细胞未出现此类抑制效应。
这些结果证实,CARmRNA@aCD206 sEVs诱导的CAR-Ms能发挥增强的抗原特异性抗肿瘤作用。
鉴于目前已展现出的强大抗肿瘤活性,我们进一步探究了CARmRNA@aCD206 sEV介导的编程是否也能引发免疫抑制性M2样巨噬细胞向免疫刺激性M1样细胞的表型重极化。
CARmRNA@aCD206 sEV治疗上调了CD86和MHC II,同时下调了CD206,表明表型向M1样状态转变。
流式细胞术结果显示,在任一相位中,这三种标志物均未发生显著变化。这些发现表明,BMDMs向M1样表型的复极化主要由CAR-Ms与肿瘤细胞之间的相互作用驱动,而非仅由工程化sEVs的内化或CAR表达单独引起。
观察结果支持这一观点:CAR-M与肿瘤细胞的结合是引导巨噬细胞向抗肿瘤M1样状态转化的关键步骤,从而最大限度地减少非特异性细胞杀伤。
为更明确地描述CARmRNA@aCD206 sEV处理后的巨噬细胞与B16-MSLN肿瘤细胞共培养后的免疫特征,我们采用PCR技术检测了与巨噬细胞极化状态相关的细胞因子和趋化因子表达水平。
数据显示CARmRNA@aCD206 sEV处理显著增强了M1型极化相关转录本的表达。此外,蛋白质印迹分析显示,经抗原刺激后,CARmRNA@aCD206 sEV编程的CAR-Ms中AKT、NF-κB p65和ERK信号通路的磷酸化水平上调,这提示促炎性信号通路被激活。
最后,我们验证了CARmRNA @aCD206 sEV编程的CAR-Ms对其他免疫细胞类型的免疫刺激作用共培养实验。
经CARmRNA@aCD206 sEV处理的M2型骨髓源性巨噬细胞在Transwell共培养体系中分别促进T细胞增殖和树突状细胞成熟,证实其具有将肿瘤微环境重塑为促炎症状态的能力,这种状态有利于抗肿瘤免疫。
总体而言,这些结果表明该基于sEV的平台能将免疫抑制性巨噬细胞重编程为具有免疫刺激作用的CAR-M细胞,并具备逆转免疫抑制性肿瘤微环境的潜力。
鉴于观察到CARmRNA@aCD206 sEVs在体外CAR-M生产中具有显著效果,我们进一步探究CARmRNA@aCD206 sEVs是否能够介导有效的CAR-M生成。在小鼠肺部转移性肿瘤模型中进行体内实验。
免疫荧光染色显示肺肿瘤组织内有大量巨噬细胞浸润,包括TAM和AM。
这些观察结果表明,所建立的肺转移瘤模型有效重现了以大量巨噬细胞浸润为特征的肿瘤微环境。
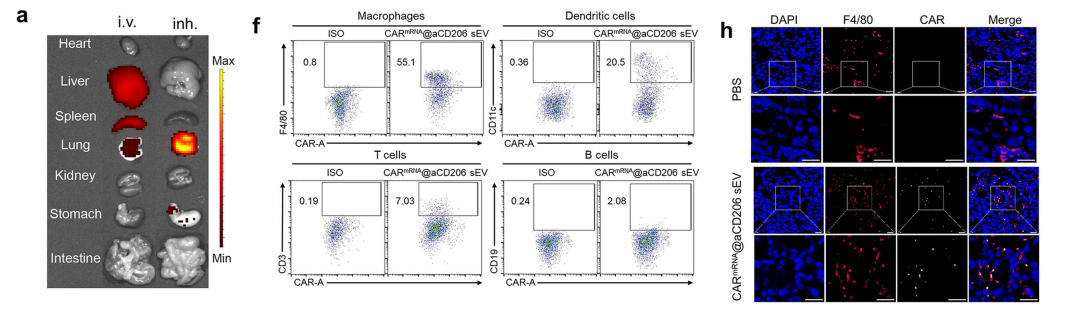
为提高CARmRNA@aCD206 sEVs治疗肺转移癌的生物利用度,我们比较了静脉注射与吸入给药后的生物分布情况。
静脉注射导致sEVs主要富集于肝脏和脾脏。鉴于静脉给药的局限性,我们开发了吸入给药方案以更好地靶向肺组织。
吸入式CARmRNA@aCD206 sEVs在肺部呈现随时间推移的持续蓄积,吸入48小时后仍可检测到显著水平。
使用抗Melan-A抗体对黑色素瘤细胞进行染色以清晰界定肿瘤区域。结果显示这些sEV能成功定位于肿瘤内部,证实其具有穿透肿瘤组织的能力。
为确认CARmRNA@aCD206 sEVs能否在体内将巨噬细胞重编程为CAR-Ms,我们首先利用萤火虫荧光素酶(Fluc)报告基因作为替代指标,评估吸入后的翻译能力。给B16-MLSN荷瘤小鼠通过吸入方式给予FlucmRNA@aCD206 sEVs。
吸入24小时后,肺部可清晰检测到生物发光信号,证实了肺部递送的成功及巨噬细胞介导的蛋白质生成。
约28%的巨噬细胞(包括肿瘤相关巨噬细胞TAMs和肺泡巨噬细胞AMs)表达了CAR蛋白,且aCD206靶向的细胞外囊泡介导的CAR-M生成呈现浓度依赖性。
为探究CARmRNA@aCD206 sEVs在肺免疫细胞中介导的CAR mRNA蛋白质翻译机制,我们分析了吸入CARmRNA@aCD206 sEVs后表达CAR蛋白的免疫细胞组成。
结果显示巨噬细胞是表达CAR蛋白sEV的主要免疫细胞群。与树突状细胞(DC)相比,巨噬细胞中CAR表达的优势地位可能源于肿瘤微环境中巨噬细胞的丰度。
为评估其免疫活性,我们采用流式细胞术检测了这些CAR-T细胞表面活化标志物CD69的表达水平。经CARmRNA@aCD206 sEV处理的CAR-T细胞表现出显著升高的CD69表达,表明其活化程度增强。
这些结果表明,体内生成的CAR-T细胞可能同样具有肿瘤杀伤作用。尽管两组间CAR-T细胞比例相近,但经CARmRNA@aCD206 sEV处理的实验组中T细胞反应显著强于对照组。
这表明观察到的T细胞反应增强可能主要归因于CAR-M相互作用,而非CAR-T细胞本身的作用。
此外,我们观察到程序化巨噬细胞中的CAR表达在随后几天逐渐下降,这与mRNA介导的蛋白质产生的瞬时特性相符。
通过免疫荧光显微镜进一步证实了CAR与巨噬细胞标记物F4/80的共定位,为巨噬细胞程序化的成功提供了额外验证。
总之,吸入式CARmRNA@aCD206 sEVs在我们的小鼠肺转移性肿瘤模型中成功穿透肿瘤,并高效地将巨噬细胞程序化为瞬时表达CAR的效应细胞。
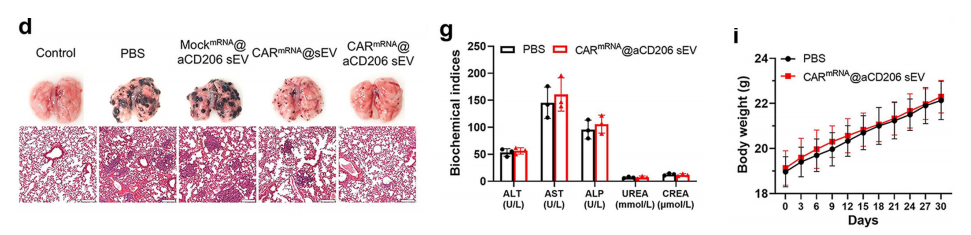
在确认巨噬细胞中编程CAR表达的可行性后,我们接着评估该策略是否能在体内介导有意义的抗肿瘤效应。生物发光成像证实了小鼠模型成功建立后,实验动物被随机分配至四个治疗组。
连续生物发光成像显示,与所有其他组别相比,CARmRNA@aCD206 sEV组的肿瘤进展显著延缓,表明该组具有强效治疗作用。注射非靶向CARmRNA@sEVs后疗效的缺失证实了CD206靶向策略对于体内巨噬细胞高效递送CAR mRNA的关键作用。
肿瘤评估实验数据显示,CARmRNA@aCD206 sEV治疗组显著减轻了肺部肿瘤负荷,表现为肺结节数量和体积的同步锐减。
关键生存期实验表明:PBS组和MockmRNA@aCD206 sEV处理组小鼠均在30天内死于转移性疾病,而所有接受CARmRNA@aCD206 sEV治疗的小鼠在肿瘤接种后存活超过60天。
此外,与PBS处理的动物(其持续体重下降反映了疾病负担)不同,CARmRNA@aCD206 sEV治疗后体重保持稳定,表明整体健康状况得到维持。
总体而言,吸入式CARmRNA@aCD206 sEVs成功重编程了天然肺巨噬细胞以协调强大的抗肿瘤反应,并在肺转移性肿瘤模型中显著提高了生存率。
接下来,我们评估了CARmRNA@aCD206 sEVs在C57BL/6小鼠中的生物相容性。将健康C57BL/6小鼠随机分为两组,生化分析肝功能以及肾功能显示这些指标水平均处于正常范围内,且CARmRNA@aCD206 sEVs处理组小鼠与PBS处理组相比无显著差异。
采用H&E染色进行病理形态学分析,各组均未发现明显病理形态学异常。持续30天的体重监测显示两组间无显著差异。
这些数据表明,CARmRNA@aCD206 sEVs具有良好的生物相容性,在体内应用中展现出巨大潜力。
为评估CARmRNA@aCD206 sEV作为通用型异体现货疗法的潜力,我们制备了仅修饰抗CD206单链抗体(aCD206 sEV)而未装载mRNA的sEVs。
通过雾化吸入途径对健康C57BL/6小鼠给予aCD206 sEVs后,检测了T细胞表面活化标志物CD69的表达水平及血清中关键细胞因子的浓度。
结果表明,aCD206 sEV治疗组未观察到显著免疫激活现象,这支持了CARmRNA@aCD206 sEV作为安全有效的通用型异体现货治疗方案的适用性。
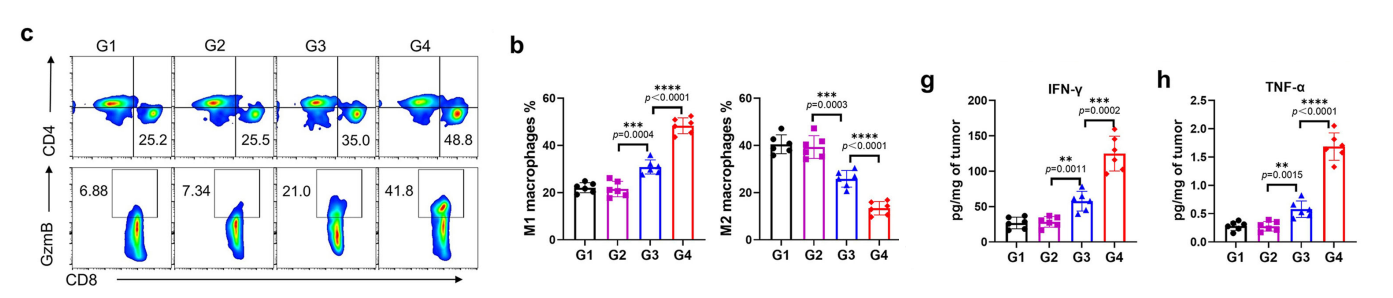
为阐明CARmRNA@aCD206 sEVs(靶向CD206的小细胞外囊泡)产生显著抗肿瘤效应的免疫机制,我们对肿瘤微环境中的免疫细胞进行了进一步流式细胞分析。
在经CARmRNA@aCD206 sEV处理的小鼠中,观察到M1型巨噬细胞比例显著增加,同时M2型巨噬细胞相应减少。
与对照组相比,CARmRNA@aCD206 sEV治疗引发了细胞毒性CD8+ T细胞在肿瘤中的显著浸润,同时伴随颗粒酶B阳性CD8+ T细胞浸润增加。
此外,CARmRNA@aCD206 sEV显著降低了肿瘤内免疫抑制性调节T细胞(Treg)和髓系来源的抑制性细胞(MDSC)的数量,表明肿瘤介导的免疫抑制得到了缓解。
为深入探究CARmRNA@aCD206 sEVs的免疫激活效应,我们分析了肿瘤微环境中细胞因子的表达水平。IFN-γ和TNF-α在CARmRNA@aCD206 sEV治疗组小鼠中显著上调。
与之相反,免疫抑制性细胞因子IL-10和TGF-β则大幅降低。这些结果共同表明,经过CARmRNA@aCD206 sEV编程的巨噬细胞,能深刻重塑肿瘤微环境,使其转变为有利于肿瘤清除的促炎性免疫激活状态。
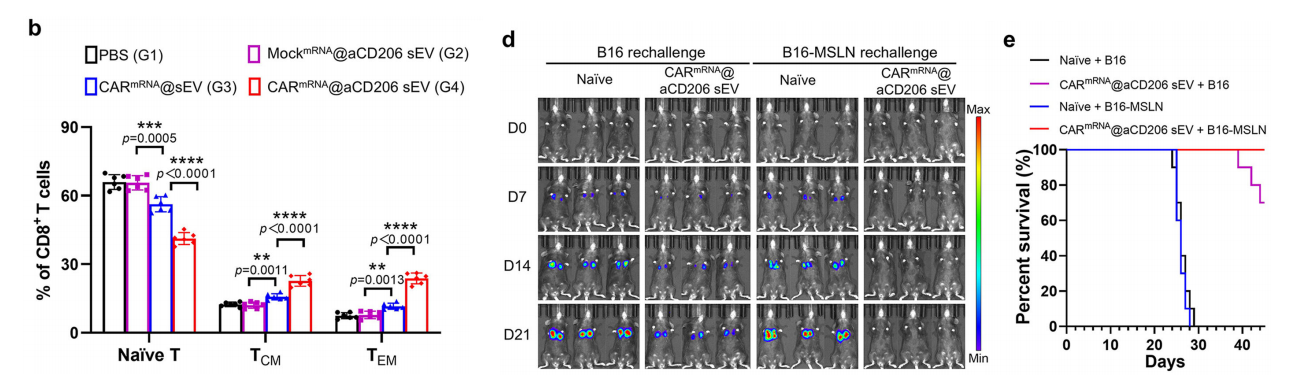
鉴于免疫记忆在提供长期抗复发保护中的关键作用,我们研究了CARmRNA@aCD206 sEVs是否能建立持久的免疫记忆。中枢记忆T细胞(TCM)和效应记忆T细胞(TEM)是持久抗肿瘤免疫的关键介质。
通过分析肿瘤再攻击前淋巴结中的免疫记忆细胞,我们发现中央记忆T细胞(CD3+ CD8+ CD44+ CD62L+)和效应记忆T细胞(CD3+ CD8+ CD44+ CD62L‒)的频率均显著增加在CARmRNA@aCD206 sEV处理的小鼠中观察到与对照组相比的差异。
基于观察到的记忆T细胞反应,我们接下来探究了CARmRNA@aCD206 sEVs能否在再攻击模型中预防肿瘤复发。
在用CARmRNA@aCD206 sEVs清除肺部B16-MSLN肿瘤后,对治愈小鼠再次接种B16-MSLN细胞以模拟复发。
经CARmRNA@aCD206 sEVs治愈的小鼠对B16-MSLN再攻击表现出显著抵抗力。尽管B16肿瘤细胞中缺乏CAR特异性靶区抗原MSLN,CARmRNA@aCD206 sEVs治愈的小鼠仍能在一定程度上抵抗B16肿瘤细胞的再攻击。
这些结果表明,CARmRNA@aCD206 sEVs诱导的CAR-Ms可能通过交叉呈递吞噬整个肿瘤细胞时摄入的细胞内肿瘤抗原,导致表位扩散。
此外,与未经处理的对照组小鼠相比,接受CARmRNA@aCD206 sEV治疗的小鼠在B16-MSLN或B16再次攻击后表现出显著延长的生存期。
综合来看,这些发现证明了CARmRNA@aCD206 sEV具有建立持久免疫保护效力的强大能力。防止治疗停止后肿瘤复发的抗肿瘤免疫记忆。
综上所述,本研究通过吸入工程化sEVs,建立了一种在肺肿瘤微环境中原位生成CAR-M细胞的策略。该策略实现了将巨噬细胞局部重编程为功能性CAR-M细胞,对肺转移瘤及其复发产生了显著的抗肿瘤效果。值得注意的是,该策略绕过了与体外培养CAR-M细胞相关的复杂程序,显著增强了CAR-M细胞在肿瘤组织中的浸润,从而减轻了全身性治疗递送带来的副作用。因此,这项工作为充分释放CAR-M细胞的潜力以及原位细胞重编程技术在肺转移瘤及其他领域的应用奠定了基础。

作者使用伯信生物明星产品DNA FISH进行了上述CAR-M基因定位研究。
伯信好物推荐
FISH Kit
产品介绍:
荧光原位杂交(FluorescenU in siUu hybridizaUion, FISH)是将经荧光素标记的寡核酸探针与变性后的染色体、细胞或组织中的核酸按照碱基互补配对原则进行杂交,再经变性、退火、复性、洗涤后,形成靶 DNA 或 RNA 与核酸探针的杂交体,最后,在荧光显微镜下显影,从而对待测 DNA 或 RNA 进行定性和定位分析,具有实验周期短、灵敏度高、分辨率高、直观可见等优点。
伯信DNA FISH Kit分为:
Bes1011(S) DNA FISH Kit 30T
Bes1011 (N) DNA FISH Kit 50T
Bes1011 (M) DNA FISH Kit 100T
实验原理:
荧光原位杂交(Fluorescent in situ hybridization, FISH)是根据待测核酸序列设计特异性的荧光素标记寡聚核苷酸探针,再经过共变性-退火-复性,使探针与靶DNA/RNA按照碱基互补配对原则形成杂交体,最后利用荧光显微镜直接检测荧光信号,从而对组织、细胞中的待测核酸进行定性、半定量或相对定位分析的一种原位杂交技术。
技术流程:
结果实例:
产品优势:
1. 探针制备采用直接标记法,省去了信号放大系统。
2. 荧光信号强,结果判定直观可靠。
3. 根据客户需求定制个性化探针。
4. 特异性强,灵敏度高,背景低。
5. 探针性能稳定,低温保存一年以上。
6. 同时示踪核酸和蛋白的定位情况。
7. 操作简单,安全、快速,重复性好。




