实验介绍
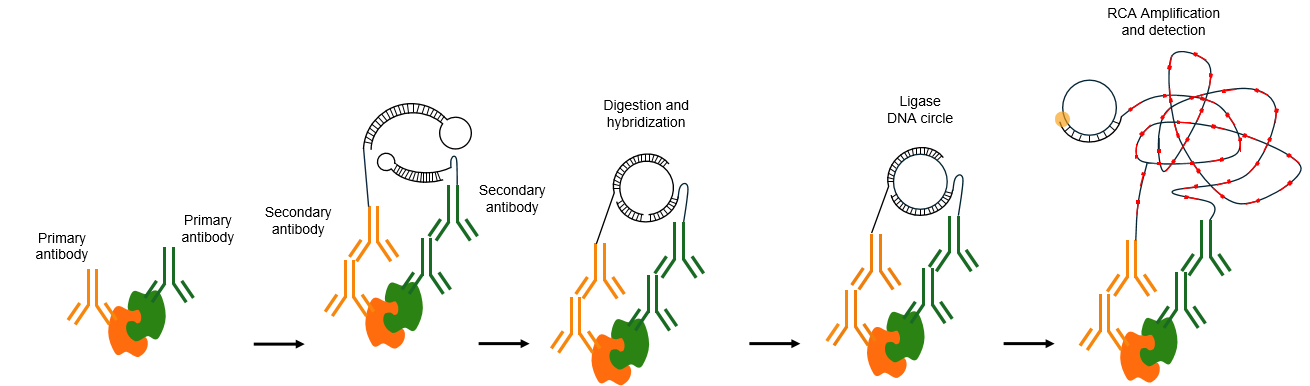
邻位连接技术(Proximity Ligation Assay, PLA) 的核心逻辑是 “双抗体识别→邻近探针连接→信号扩增→原位检测”,仅当两个目标分子(蛋白或修饰位点)距离足够近(通常 < 40 nm,即分子间可发生直接互作的距离)时,才能启动信号输出,具体步骤如下:
1. 特异性识别(双抗体结合):用两种不同种属来源的一抗分别识别目标互作蛋白(如蛋白 A 和蛋白 B):一抗 1 靶向蛋白 A,一抗 2 靶向蛋白 B,且二者需来自不同物种(如兔源抗 A、鼠源抗 B),避免交叉反应。
2. 探针偶联(二级抗体 - 寡核苷酸结合):加入 “种属特异性二级抗体 - 寡核苷酸探针” 复合物:抗兔二抗偶联探针 1(含一段单链 DNA),抗鼠二抗偶联探针 2(含另一段互补单链 DNA)。此时,若蛋白 A 与 B 发生互作(距离 < 40 nm),则探针 1 与探针 2 会因抗体的结合而彼此邻近。
3. 邻近连接(DNA 连接酶催化):加入连接酶:仅当探针 1 与探针 2 距离足够近(<40 nm)时,二者的互补 DNA 序列可通过碱基配对形成局部双链,被连接酶连接成一个完整的 DNA 环。若蛋白 A 与 B 不互作(距离过远),探针无法靠近,连接反应不发生。
4. 信号扩增与检测:加入引物和 DNA 聚合酶,以连接形成的 DNA 环为模板进行滚环扩增(Rolling Circle Amplification, RCA):扩增产物(长单链 DNA)可与荧光标记的探针杂交,形成一个明亮的荧光点(每个互作事件对应一个荧光点)。
5. 通过荧光显微镜观察:荧光点的位置反映互作发生的细胞内定位,荧光点的数量可定量互作强度。
技术流程
技术优势
1、抓得住“瞬间”:传统方法追不上的瞬时互作,比如VEGF调控的蛋白复合物动态变化,它能精准捕捉时间轨迹。
2、找得到“位置”:直接定位互作发生在细胞核、高尔基体还是线粒体,就像给蛋白互作标了“GPS”。
3、信得过“数据”:双重抗体+DNA连接的双重验证,假阳性率极低,荧光强度还能定量分析,数据直接用在论文里超硬气 。
客户提供
① 组织:新鲜或固定(10%中性甲醛、4%多聚甲醛)组织样本;
② 细胞:新鲜(大于106)或固定(10%中性甲醛、4%多聚甲醛)细胞样本;
③ 切片:石蜡切片,冰冻切片以及细胞爬片,涂片;
④ 实验信息:基因名称及ID;
⑤ 实验材料:两个蛋白抗体一抗(分别为鼠抗、兔抗);
伯信提供
① 染色后的切片;
② 电子图片(共聚焦拍照);
③ 实验报告(实验仪器、试剂、方法、结果、结论)。
结果实例




