M6A-Methylated circRAPGEF5 drives lung adenocarcinoma progression and metastasis via IGF2BP2/NUP160-mediated autophagy suppression
(IF=33.899)《Molecular Cancer》
摘要
背景:
肺腺癌(LUAD)作为非小细胞肺癌最主要的组织学亚型,其肿瘤发生过程中RNA结合蛋白(RBPs)和环状RNA(circRNAs)发挥着关键的调控作用。
最新研究证据表明,环状RNA-自噬调控轴是癌症进展的关键调节器。本研究系统性地探讨了RBP-环状RNA-自噬网络在肺腺癌发病机制中的功能相互作用。
方法:
通过RNA pull down、质谱分析和RNA免疫沉淀技术,我们成功探索了circRAPGEF5的结合蛋白。采用m6A甲基化RNA免疫沉淀-PCR技术进行m6A修饰分析。
通过免疫荧光(IF)和荧光原位杂交(FISH)实验确定了靶基因的亚细胞定位。利用mRFP-GFP-LC3荧光慢病毒标记技术实现了自噬流水平的监测。小鼠异种移植实验证实了circRAPGEF5的功能作用。
结果:
通过全面的分子特征分析,我们发现肺腺癌细胞中circRAPGEF5表达升高,这种环状RNA显著抑制自噬流,同时促进包括增殖、迁移和侵袭能力增强在内的恶性表型。
机制研究表明,circRAPGEF5直接与m6A阅读蛋白——胰岛素样生长因子2 mRNA结合蛋白2(IGF2BP2)的KH3-4功能结构域相互作用。这一相互作用促进了IGF2BP2介导的核孔复合体组分NUP160 mRNA的稳定化。
通过RNA干扰对NUP160进行基因敲除,有效恢复了自噬活性,从而减弱了肺腺癌细胞的侵袭性生物学行为。
利用异种移植模型进行的体内验证表明,
circRAPGEF5/IGF2BP2/NUP160信号轴通过抑制自噬促进了肿瘤生长和转移扩散。
结论:
我们的研究揭示了一种新型表观遗传调控机制:m6A修饰的环状RNA circRAPGEF5通过IGF2BP2依赖性稳定NUP160转录本的方式调控自噬抑制,最终驱动肺腺癌(LUAD)的进展和转移。
这些发现确立了circRAPGEF5/IGF2BP2/NUP160信号轴作为肺腺癌干预的潜在治疗靶区。
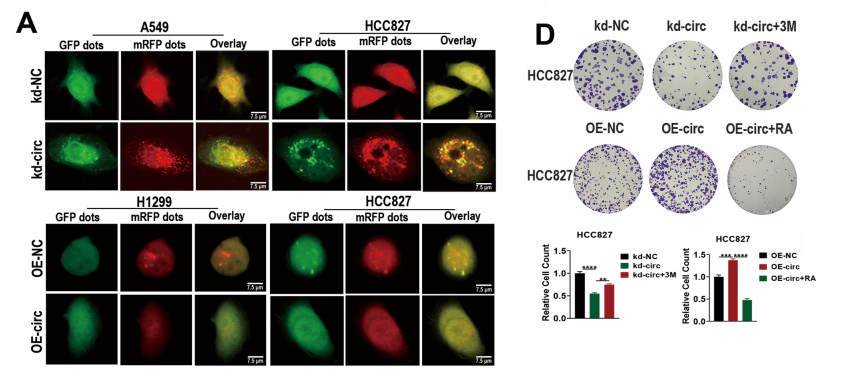
我们先前的研究表明,circRAPGEF5在肺腺癌(LUAD)患者中表达升高,通过miRNA-126-3p/ZEB1轴促进肺腺癌的增殖、迁移、侵袭和上皮间质转化。在此研究基础上,我们发现circRAPGEF5与自噬过程密切相关。
敲低circRAPGEF5会增加自噬溶酶体和自噬体的数量,而过表达circRAPGEF5则会减少这些结构。WB实验对自噬相关蛋白的分析显示,circRAPGEF5敲低会降低P62并增加LC3-II/I,而circRAPGEF5过表达则产生相反效果。
使用3-MA抑制自噬以及RAPA诱导自噬的效果在LUAD细胞中得到验证。自噬抑制剂3-MA促进了上皮间质转化(EMT)、迁移和侵袭,而RAPA则抑制了LUAD细胞中的这些过程。3-MA逆转了circRAPGEF5基因敲除对细胞增殖、迁移、侵袭和克隆形成的抑制作用。
相反,RAPA逆转了circRAPGEF5过表达对这些细胞过程的促进作用。我们的研究结果表明,circRAPGEF5通过抑制LUAD细胞的自噬作用,从而增强其增殖、迁移、侵袭和集落形成能力。
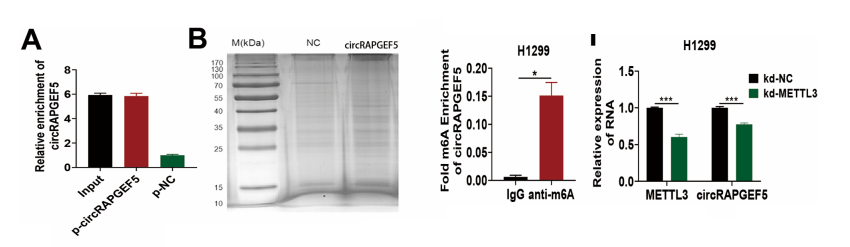
为阐明circRAPGEF5介导自噬的分子机制,我们进行了RNA pull down实验。硝酸银染色显示circRAPGEF5探针组存在明显蛋白条带。质谱分析与WB实验证实circRAPGEF5探针组与IGF2BP2存在显著结合。
RIP实验显示IGF2BP2抗体组中circRAPGEF5的富集显著增加,证实了IGF2BP2与circRAPGEF5之间的相互作用。IF和FISH结果表明细胞质中IGF2BP2与circRAPGEF5的共定位现象。
运用SRAMP工具预测circRAPGEF5甲基化丰度时,发现circRAPGEF5存在大量甲基化位点。meRIP实验检测显示,A549和H1299细胞中circRAPGEF5甲基化水平更高,尤其在抗m6A抗体组中更为显著。敲低METTL3会降低circRAPGEF5的表达水平。
此外,敲低或过表达IGF2BP2分别抑制或促进了circRAPGEF5的表达。敲低METTL3减弱了IGF2BP2与circRAPGEF5的结合。
为确定IGF2BP2与circRAPGEF5的结合位点,研究人员构建了六个含有不同IGF2BP2片段的质粒,RIP实验结果表明IGF2BP2主要通过与circRAPGEF5的KH3-4区域结合。
为验证IGF2BP2蛋白KH3-4结构域的生物学功能,我们在敲低circRAPGEF5后分别转染野生型与KH3-4缺失型IGF2BP2质粒。与野生型相比,KH3-4缺失质粒对circRAPGEF5的反应显著减弱。
细胞学实验进一步表明,IGF2BP2质粒KH3-4区域的缺失会削弱肺腺癌细胞的增殖与转移能力。这些发现共同表明:circRAPGEF5通过与IGF2BP2结合,其表达受到m6A修饰与IGF2BP2的精密调控。
我们在TCGA数据库的临床配对组织样本中观察到高表达IGF2BP2的患者表现出较短的总生存期。A549细胞显示低IGF2BP2水平,而H1299和HCC827细胞则呈现高表达。
我们在H1299和HCC827细胞中构建了IGF2BP2敲低细胞系,并在A549和HCC827细胞中构建了IGF2BP2过表达细胞系。Sh1-IGF2BP2显著降低了IGF2BP2水平,并被用于后续敲低IGF2BP2表达的实验。
CCK-8与EdU检测显示,IGF2BP2过表达后A549和HCC827细胞的增殖均显著增强。相反,敲低IGF2BP2显著抑制了H1299和HCC827细胞的增殖。
迁移侵袭实验表明,IGF2BP2过表达显著促进A549和HCC827细胞的迁移侵袭能力,而敲低IGF2BP2则抑制H1299和HCC827细胞的迁移侵袭。
集落形成实验表明,IGF2BP2过表达能促进集落形成,而敲低IGF2BP2则会抑制H1299和HCC827细胞的集落形成。
蛋白质印迹实验显示,敲低IGF2BP2抑制了H1299和HCC827细胞中N-钙黏蛋白和波形蛋白的表达,上调了E-钙黏蛋白的表达。
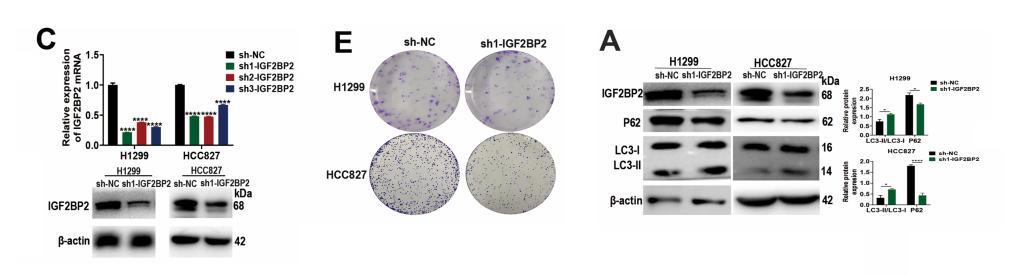
为探究circRAPGEF5结合蛋白IGF2BP2与肺腺癌细胞自噬之间的潜在关联,我们分析了自噬相关蛋白及自噬流水平。
研究结果表明,IGF2BP2的减少会导致P62水平下降和LC3-II/I比值升高,且敲低IGF2BP2会引起自噬溶酶体及自噬体水平上升。
值得注意的是,3-MA逆转了敲低IGF2BP2后对细胞增殖、迁移和侵袭的抑制作用,而RAPA在IGF2BP2过表达后抑制了LUAD细胞中的这些过程。
实验结果表明,IGF2BP2表达升高促进LUAD细胞的增殖、迁移、侵袭和EMT,而抑制IGF2BP2在体外会引发自噬。
为证实circRAPGEF5与IGF2BP2的关联性,我们开展了后续实验。CCK-8与EdU检测、迁移侵袭实验、克隆形成实验及蛋白质印迹分析均证实,敲低IGF2BP2可逆转circRAPGEF5过表达对肺腺癌细胞增殖、迁移、侵袭、克隆形成及上皮间质转化的促进作用。
反之,IGF2BP2的过表达能抵消circRAPGEF5敲低对肺腺癌细胞上述过程的抑制作用。这些结果表明IGF2BP2与circRAPGEF5协同促进肺腺癌的转移与进展。
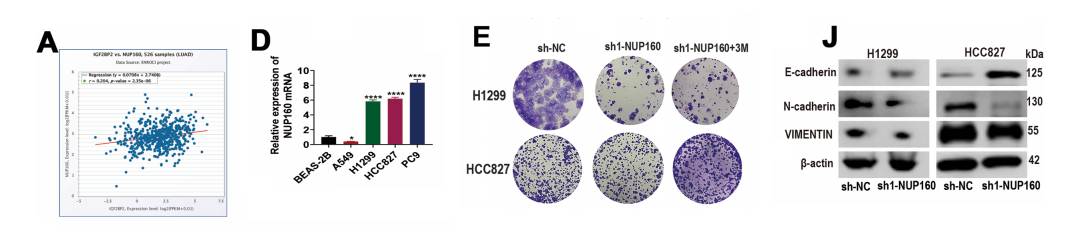
为探索IGF2BP2的靶区基因,我们利用StarBase数据库进行预测。结果显示NUP160可能是IGF2BP2作用的关键分子,且与IGF2BP2呈正相关。
荧光原位杂交与免疫荧光双染显示NUP160主要与circRAPGEF5在细胞质中共定位。RIP实验表明IGF2BP2与NUP160之间存在相互作用。
NUP160 mRNA在A549细胞中表达水平较低,而在H1299和HCC827细胞中高表达,因此选择H1299和HCC827细胞进行后续研究。
我们发现sh1-NUP160能有效降低H1299和HCC827细胞中的NUP160水平,该载体被用于敲低NUP160表达。随后,NUP160基因敲除显著抑制了肺腺癌(LUAD)细胞的增殖、迁移、侵袭、上皮间质转化(EMT)及集落形成能力。
此外,放线菌素D实验表明IGF2BP2在稳定细胞内NUP160 mRNA表达方面发挥作用。
先前的研究表明,敲除NUP160基因会抑制细胞增殖并诱导细胞凋亡和自噬。
为进一步探究这一现象,我们检测了自噬相关蛋白P62和LC3-II/I的表达水平。结果显示,在NUP160基因敲除后,P62蛋白表达量下降而LC3-II/I比值上升。NUP160基因敲除后,自噬体和溶酶体数量增加。
自噬抑制剂3-MA可逆转NUP160敲除后对细胞增殖、迁移和侵袭的抑制作用。这些发现共同表明:IGF2BP2与NUP160结合并稳定其mRNA表达,而NUP160敲除会在体外诱导肺腺癌细胞发生自噬。
在H1299和HCC827细胞中进行NUP160敲低与IGF2BP2过表达后的细胞功能检测,CCK-8与EdU实验显示:NUP160敲低逆转了IGF2BP2过表达对肺腺癌细胞的增殖促进作用。
迁移和侵袭实验显示,敲低NUP160可逆转IGF2BP2过表达在LUAD细胞中促进迁移和侵袭的能力。集落形成实验表明,NUP160敲低逆转了IGF2BP2过表达在LUAD细胞中促进集落形成的作用。
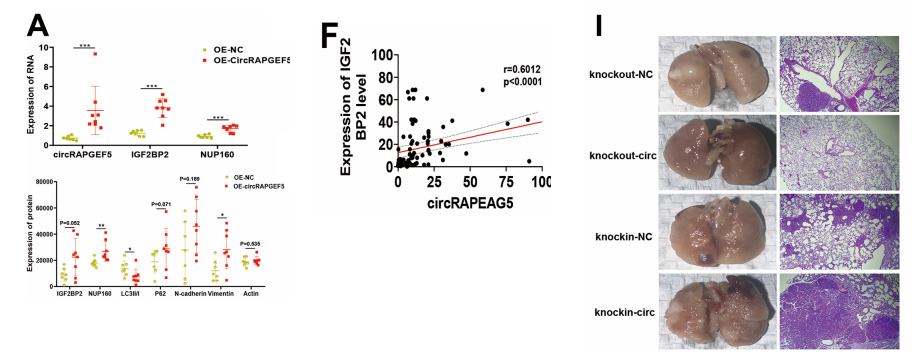
我们此前在裸鼠体内建立了OE-NC和OE-circRAPGEF5的肿瘤移植模型,以研究circRAPGEF5的ceRNA机制。随后,我们用这些小鼠的肿瘤组织进行了RT-qPCR和WB实验。
研究结果表明,circRAPGEF5的体内过表达会导致IGF2BP2和NUP160 mRNA的表达增加。蛋白质印迹实验显示,在circRAPGEF5过表达组中P62和IGF2BP2水平升高,而LC3-II/I比值下降。
此外,N-钙黏蛋白和波形蛋白表达量上调。我们收集了93例肺腺癌样本,实时定量PCR结果显示circRAPGEF5/IGF2BP2/NUP160的表达量上调。
此外,我们还分析了circRAPGEF5/IGF2BP2/NUP160之间的相关性。circRAPGEF5、IGF2BP2和NUP160高表达的患者生存期较短。
综上所述,我们的研究结果表明,m6A甲基化的circRAPGEF5与IGF2BP2结合,通过IGF2BP2/NUP160信号轴抑制LUAD细胞的自噬作用。
这一过程促进了LUAD细胞的增殖、侵袭和迁移,最终导致LUAD的转移和进展。这些发现表明,circRAPGEF5可能作为开发LUAD新型治疗干预措施的潜在靶区。


作者使用伯信生物明星产品RIP、MeRIP试剂盒进行了上述筛选与分子互作调控机制的研究。




