N6-methyladnosine of vRNA facilitates influenza A virus replication by promoting the interaction of vRNA with polymerase proteins
《PNAS》(IF=9.1005)
摘要
甲型流感病毒(IAV)的正链和负链RNA中均存在N6-甲基腺苷(m6 A)修饰,这种修饰会影响病毒的复制能力和致病性。然而,关于m6 A在IAV RNA中的调控机制仍知之甚少。
本研究通过分析不同亚型IAV病毒RNA的m6 A甲基化情况,发现该修饰能显著提升RNA聚合酶活性并促进病毒复制。通过在IAV多种病毒RNA(vRNA)上敲除m6 A甲基化基序,我们证实vRNA中m6 A缺失会抑制病毒基因表达及体外复制能力。
此外,vRNA中的m6 A缺失还会降低IAV在小鼠模型中的致病性。从机制层面分析,vRNA中m6 A的缺失通过依赖m6 A甲基转移酶的方式,破坏vRNA与vRNP蛋白的相互作用,从而阻碍病毒核糖核蛋白复合体(vRNP)的组装——但不影响m6 A识别蛋白的功能。
综合研究结果表明,m6A修饰在病毒RNA中发挥着关键作用:既能促进RNA聚合酶复合体的活性,又能调控病毒复制和致病性,这一发现为开发新型抗流感策略提供了重要理论依据。
先前研究显示,两种适应小鼠的实验室H1N1病毒株PR8和WSN的病毒RNA中均含有内部m6 A修饰。
H1N1、H3N2、H7N9和H9N2病毒的病毒转录本中均存在m6 A修饰,同时在感染H5N6病毒的MDCK、RAW264.7、VERO和HD11细胞(分别来源于犬类、啮齿类、灵长类和禽类)的病毒RNA中也检测到该修饰。
这些数据表明,甲型流感病毒各亚型的vRNA、cRNA和mRNA中均存在m6 A残基,且vRNA的m6 A修饰在不同亚型和物种间具有保守性。
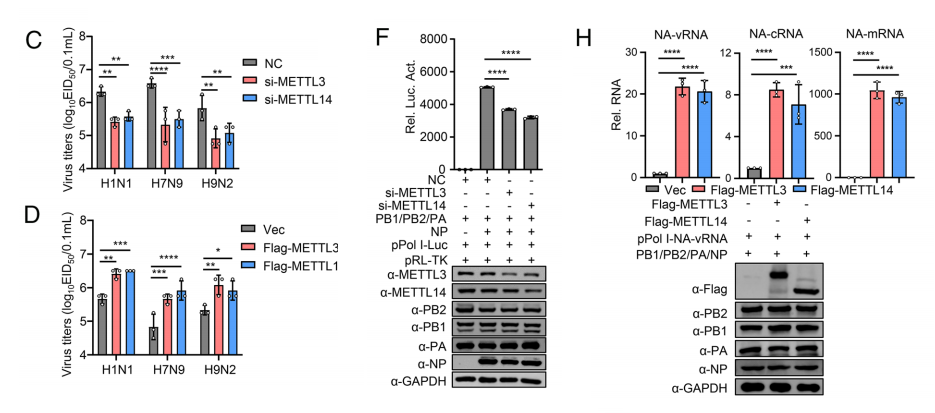
为探究m6 A修饰对甲型流感病毒(IAV)复制的影响,我们采用siRNA技术敲低甲基转移酶METTL3和METTL14的表达。敲低这两种酶会显著抑制SC15病毒的复制,而过表达则能显著促进病毒增殖。
此外,METTL3和METTL14还能促进H1N1、H7N9及H9N2病毒在A549细胞中的复制。值得注意的是,敲低METTL3和METTL14会大幅降低病毒RNA的m6 A修饰水平,而过表达METTL3则能逆转这种修饰的减少趋势。
过表达METTL3和METTL14还能促进感染细胞中IAV的vRNA、cRNA及mRNA表达。
由于病毒RNA的表达水平与RdRP活性直接相关,我们进一步探究了甲基腺苷酸化修饰对甲型流感病毒RdRP活性的影响。
首先,我们验证了萤火虫荧光素酶基因的负链和正链转录本均含有m6 A修饰。实验发现,敲低METTL3和METTL14基因会降低病毒RdRP活性,而过表达这两种基因则能以剂量依赖的方式增强RdRP活性。
我们还构建了pPol I-NA-vRNA质粒,用于在人类RNA聚合酶I启动子调控下表达NA vRNA。
通过转染PB2、PB1、PA和NP表达质粒及pPol I-NA-vRNA的细胞实验发现,METTL3和METTL14的过表达不仅显著提升了vRNA的表达水平,还增强了由vRNA转录产生的cRNA和mRNA的复制效率。
这些数据表明,m6A甲基转移酶在流感病毒RNA合成及其复制过程中发挥着关键作用。
为绘制SC15病毒基因组与转录组中的m6 A修饰位点,对样本进行m6 A免疫沉淀实验,并采用高通量测序技术(meRIP-seq)进行分析。
结果显示m6 A峰遍布整个病毒基因组和转录组。这些结果验证了我们识别病毒基因组中m6 A位点的方法。
通过整合meRIPseq数据并运用生物信息学分析工具,我们在SC15基因片段的正负链上鉴定出高可靠性m6 A位点:NP基因负链6个位点、NA基因负链4个位点、PB1基因负链2个位点。
为直接验证m6 A在甲型H1N1流感病毒复制中的作用,我们在不改变编码氨基酸的前提下对m6 A位点进行突变,并构建了NP、NA或PB1病毒RNA中缺失m6 A位点的重组突变病毒。
通过miRIP-qPCR检测发现,突变病毒中NP vRNA的m6 A水平显著降低,而PA/PB1 vRNA及NP mRNA的m6 A水平则未受影响。
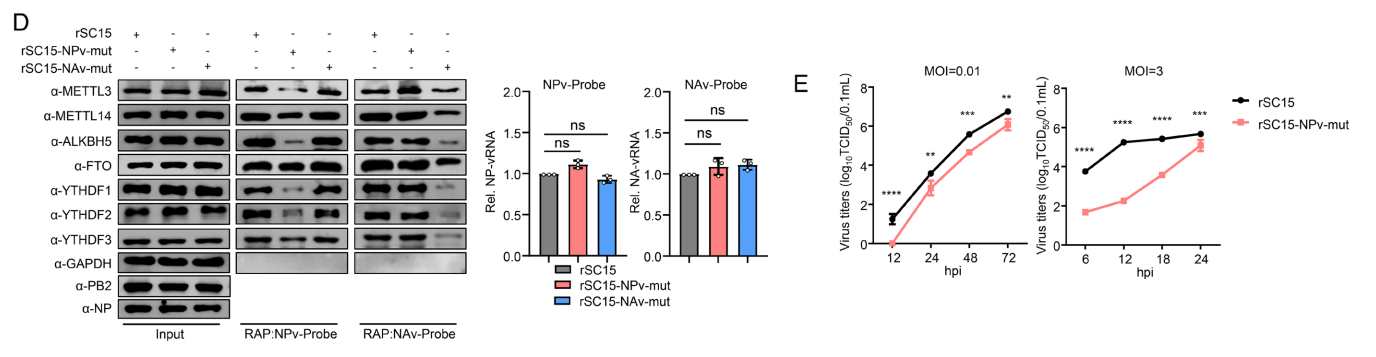
为进一步探究病毒RNA与m6 A相关蛋白在感染细胞中的相互作用,我们采用生物素标记的NP/NA病毒RNA特异性探针进行免疫共沉淀实验。
结果显示,在rSC15-NPv-mut和rSC15-NAv-mut突变株中,NP或NA病毒RNA与m6 A相关蛋白的相互作用受到显著抑制。
这表明突变株中的病毒RNA确实存在m6 A甲基化缺陷。
我们首先检测了突变病毒中m6 A缺失对病毒复制的影响。病毒生长动力学分析显示,rSC15-NPv-mut病毒的蛋白表达量和复制能力均显著降低。
在A549细胞中,m6 A缺失持续抑制了rSC15-NAv-mut和rSC15-PB1v-mut病毒的复制能力。综合实验结果表明,vRNA中的m6A缺失会显著降低甲型流感病毒的体外复制效率。
为探究m6 A甲基化修饰在病毒RNA中对甲型流感病毒毒力的影响,我们通过小鼠模型评估了野生型(WT)和突变型病毒的复制能力与致病性。
结果显示,野生型病毒引发严重疾病,其半数致死剂量(MLD50)为103.17 EID50,导致小鼠死亡。
而突变型病毒的致死率则显著降低,MLD50值分别降至104.38、104.5和104.68 EID50。接种rSC15病毒的小鼠肺部、鼻甲及脑组织中的病毒滴度,明显高于接种突变型病毒的对照组小鼠。
与这些发现一致的是,病理学检查结果表明,rSC15病毒感染对肺部造成了严重损伤,具体表现为肺泡出现大量细支气管化、广泛的免疫细胞浸润以及强烈的炎症反应。
相比之下,突变病毒在感染后第3天和第5天引发的组织损伤则相对轻微。
这些结果共同表明,vRNA中m6 A的缺乏显著降低了IAV在小鼠中的复制和致病性。
接下来我们研究了病毒RNA的m6 A修饰如何影响甲型流感病毒(IAV)的复制和致病性。本研究发现,在感染野生型或突变型病毒的细胞中,或转染表达野生型与m6 A缺陷型NP病毒RNA的质粒时,m6 A缺失会促进病毒RNA与RNA传感器RIG-I的相互作用。
这些结果表明,即使基因组八个片段中的某个片段缺失m6 A修饰,也不会影响IAV引发的I型干扰素应答。
鉴于病毒RNA的复制与转录是甲型流感病毒生命周期中的关键过程且由vRNP复合体介导,我们进一步探究了m6 A修饰对病毒RNA复制与转录的影响。
在病毒感染的细胞中,rSC15-NPv-mut或rSC15-NAv-mut病毒的vRNA、cRNA及mRNA表达水平均显著低于野生型病毒。
通过生物素标记的NP vRNA特异性探针进行免疫共沉淀实验发现,NP vRNA与m6 A相关蛋白的相互作用在m6 A缺陷状态下受到抑制。
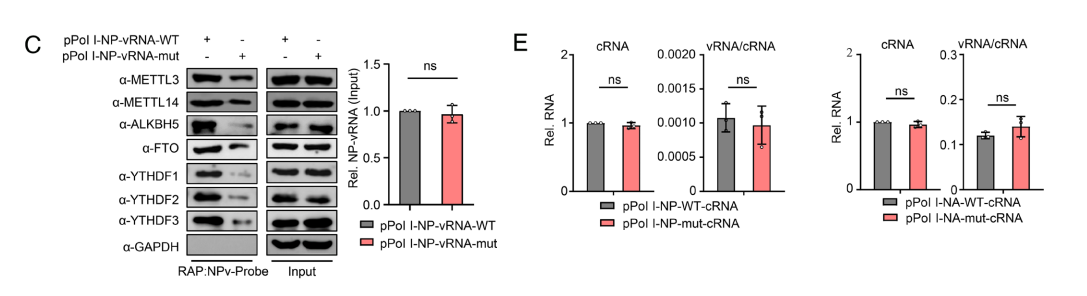
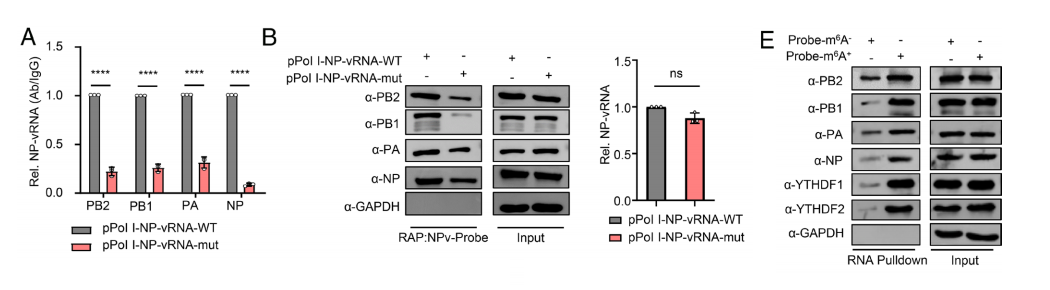
在转染了表达PR8病毒PB2、PB1、PA和NP蛋白的质粒的细胞中,vRNA的表达水平未见差异,但源自vRNA的cRNA和mRNA表达量在pPol I-NP-vRNA-mut或pPol I-NA-vRNA-mut质粒中显著下调。
研究人员构建了pPol I-NP/NA-cRNA-WT和pPol I-NP/NA-cRNA-mut质粒,分别用于表达源自rSC15、rSC15-NPv-mut病毒或rSC15-NAv-mut病毒的cRNA。
由于突变仅破坏了病毒基因组负链上的m6 A修饰基序,野生型和突变型病毒表达的cRNA均保留相同的m6 A修饰。如预期所示,源自cRNA的vRNA表达量未见显著差异。
这些结果表明,vRNA的m6 A缺失会抑制cRNA向mRNA的合成,进而阻碍由cRNA生成的子代vRNA表达。
为阐明m6 A修饰在病毒RNA复制与转录中的调控机制,我们首先分析了vRNA与vRNP蛋白的相互作用。
CLIP实验结果显示,m6 A缺陷会削弱NP蛋白携带的vRNA与质粒表达的vRNP蛋白之间的相互作用。
在转染PR8病毒株PB2、PB1、PA和NP蛋白表达质粒的细胞中,m6 A缺陷型vRNA捕获的vRNP蛋白数量明显少于野生型vRNA。
我们进一步评估了病毒感染细胞中vRNA与vRNP蛋白的相互作用。
由于突变病毒的复制效率及其在突变病毒感染细胞中的RNA表达水平均低于野生型病毒,我们对不同剂量的病毒进行了细胞感染实验。
结果显示:在rSC15或突变病毒感染的细胞中,突变型vRNA与vRNP蛋白的相互作用显著减弱,而野生型vRNA与vRNP蛋白的相互作用则未见明显差异。
突变型vRNA捕获的vRNP蛋白数量少于野生型vRNA,但与突变病毒中非突变型vRNA片段的相互作用无显著差异。
为进一步研究,我们合成了46核苷酸生物素标记的vRNA迷你手柄,并分别添加或不添加m6 A修饰。
实验发现,经m6 A修饰的vRNA捕获更多病毒蛋白及m6 A相关蛋白。这表明m6A修饰能显著增强vRNA与vRNP蛋白的相互作用。
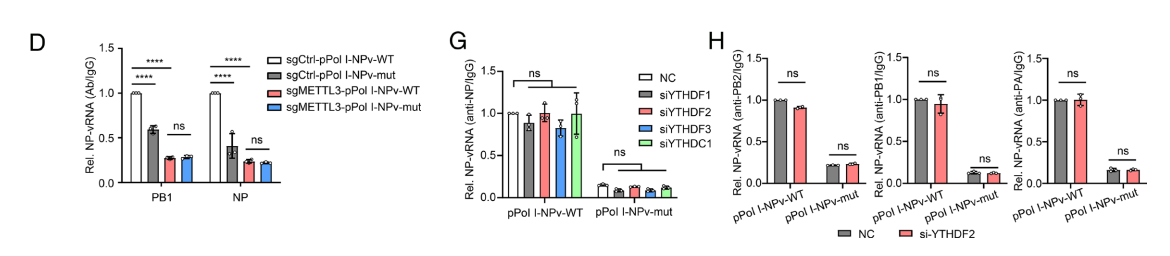
我们开始研究m6 A相关蛋白在m6 A修饰的vRNA与病毒核糖核蛋白复合物(vRNP)相互作用中的作用。
病毒生长动力学分析表明,m6 A缺失会降低rSC15在A549细胞中的复制效率。然而,在METTL3缺陷细胞中,rSC15与rSC15-NPv突变病毒的复制效率并无显著差异。
此外,m6 A缺失会降低感染细胞中vRNA、cRNA和mRNA的表达水平,而METTL3基因敲低可缓解这种下降趋势。这些结果表明,m6 A缺失通过依赖甲基转移酶的作用机制,显著抑制了病毒RNA的表达和病毒复制。
此外,异位表达的METTL3和METTL14显著增强了病毒感染细胞中NP与vRNA的相互作用。
在A549细胞中,突变型NP vRNA与PB1/NP蛋白的相互作用减少,而METTL3缺失则缩小了野生型与突变型vRNA与PB1/NP的差异。
在感染野生型或突变型病毒的细胞中,敲低METTL3/14并过表达ALKBH5/FTO可显著缩小野生型与突变型vRNA与病毒蛋白的相互作用差异。
经m6 A修饰的RNA通常被识别蛋白识别,从而赋予下游功能。因此,我们研究了识别蛋白在病毒RNA与病毒核糖核蛋白复合体(vRNP)相互作用中的作用。
病毒生长动力学分析表明,过表达YTHDF2和YTHDF3显著促进了病毒复制。然而,在敲低NC、YTHDF1/2/3或YTHDFC1的细胞中,病毒RNA与NP蛋白的相互作用未见差异。
敲低YTHDF2并未影响PB2/PB1/PA蛋白与pPol I-NP-vRNA-WT或pPol I-NP-vRNA-mut质粒衍生vRNA的相互作用。
这些数据表明,vRNA的m6A修饰促进了vRNA和vRNP蛋白以一种不依赖阅读蛋白的方式相互作用。
综上所述,我们证实病毒RNA的m6 A修饰在不同亚型的甲型流感病毒中普遍存在。研究发现,vRNA中m6 A的缺失会破坏其与病毒核糖核蛋白复合体(vRNP)的相互作用,从而抑制病毒复制并降低致病性。
这些发现揭示了m6A在调控甲型流感病毒复制和致病性中的关键作用。针对甲型流感病毒的转录后修饰进行靶向干预,可能为开发新型抗病毒治疗策略提供新思路。
未来研究将重点探讨m6 A位点在病毒正链RNA中的作用,包括其对病毒复制、先天免疫应答及病毒致病性的影响。

作者使用伯信生物明星产品RAP进行分子调控机制研究。
伯信好物推荐
RAP Kit
产品介绍:
RNA 反义纯化技术(RNA Antisense Purification,RAP)用于研究RNA与RNA、RNA与蛋白质之间的相互作用。根据研究对象不同,RAP技术结合了高通量测序(RAP-Seq)和质谱技术(RAP-MS),分别研究与目标RNA互作的RNA和蛋白质。
伯信 RAP Kit分为:
Bes5103-1(S) RAP-RNA kit 12T
Bes5103-1(N) RAP-RNA kit 30T
Bes5103-2(S) RAP-Protein kit 12T
Bes5103-2(N) RAP-Protein kit 30T
Bes5103-3(S) RAP-RNA、protein kit 12T
Bes5103-3(N) RAP-RNA、protein kit 30T
实验原理:
RAP技术通过设计生物素探针组拉取目标RNA,使与其共同作用的RNA或蛋白质(RBPs)富集在磁珠上并被洗脱。最后,通过高通量测序得到该调控RNA转录调控的下游靶基因,同时,也可以通过Western Blot验证RBPs,或通过MS鉴定未知蛋白。
技术流程:
结果实例:
产品优势:
1. 伯信独立研发,具有自主知识产权。
2. 灵敏度高,稳定性好。
3. 检测方法领先,结果准确、重复性好。




