M6A-modified circRBM33 promotes prostate cancer progression via PDHA1-mediated mitochondrial respiration regulation and presents a potential target for ARSI therapy 《International Journal of Biological Sciences》(IF=10.75)

N6-甲基腺苷(m6A)是各种类型RNA中最常见的RNA修饰,包括环状RNA(circRNAs)。
越来越多的证据表明,环状RNA可能在多种恶性肿瘤中发挥关键作用。
然而,m6A修饰环状RNA在前列腺癌(PCa)中的生物学相关性尚不清楚,有待进一步阐明。
研究团队的数据显示,circRBM33是m6A修饰的,在PCa细胞中表达比在正常细胞/组织中更高。
体外和体内实验表明,下调/上调circRBM33分别抑制/促进了肿瘤的生长和侵袭。
降低m6A水平挽救了circRBM33的肿瘤促进作用。
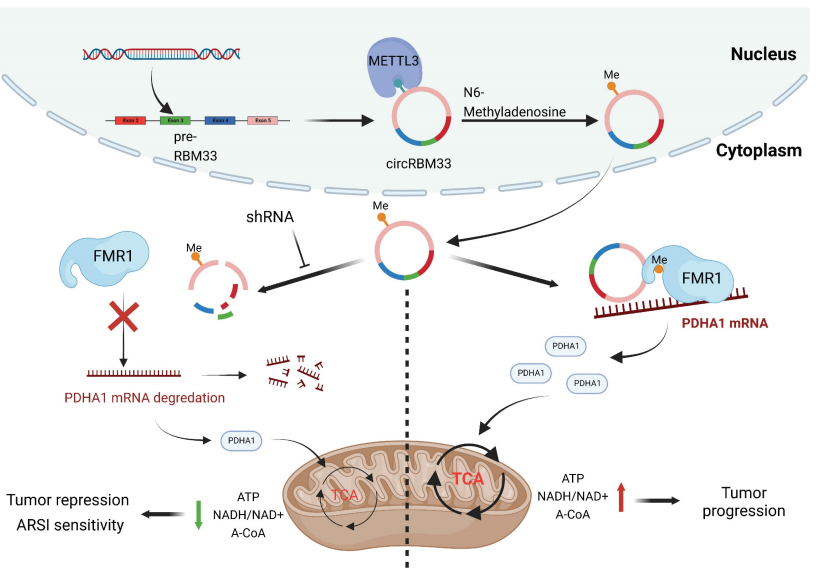
此外,一旦被m6A修饰,circRBM33通过形成一个二元复合物与FMR1相互作用,维持下游靶基因PDHA1的mRNA稳定性。
抑制/过表达circRBM33降低/增强了ATP的产生、乙酰辅酶A水平和NADH/NAD+比值。
此外,circRBM33的消耗显著增加了前列腺肿瘤中对雄激素受体信号抑制剂(ARSI)治疗的反应敏感性,包括恩杂鲁胺和达洛鲁胺。
研究团队的研究表明,m6A介导的circRBM33-FMR1复合物可以通过稳定PDHA1 mRNA来激活线粒体代谢,从而促进PCa的进展,并可以减弱 circRBM33 在 PCa 治疗中增加的 ARSI 有效性。
这种新发现的circRNA可能作为PCa的潜在治疗靶点。

研究团队整合了三种数据图谱来确定PCa中与m6A相关和预后相关的环状RNA,使用PCa细胞样本进行了MeRIP测序,以研究与m6A相关的环状RNA谱,维恩图重叠区出现了一个具有预后价值的hsa_circ_0001771相关的circRNA,circRBM33,称为hsa_circ_0001771。
研究团队从MeRIP数据中进行了基序分析,以定位假定的m6A修饰位点,其中两个基序很可能是潜在的靶点。
此外,研究团队用MeRIP方法初步检测了circRBM33是否被m6A修饰,说明circRBM33是m6A修饰的。
circRBM33表现为m6A修饰的,并作为PCa的BCR预后指标。
关于细胞质中非编码RNA(ncRNA)中ceRNA(竞争内源性RNA)机制的优势,研究团队进行了AGO2-RIP实验并排除了circRBM33声称是ceRNA的说法。
通过来自这两个数据库的信息整合,FMR1,也被称为FMRP(脆性X智力迟钝蛋白),因与circRBM33的相互作用,更重要的是,FISH检测显示了它们的细胞质共定位,表明它们之间可能存在相互作用。
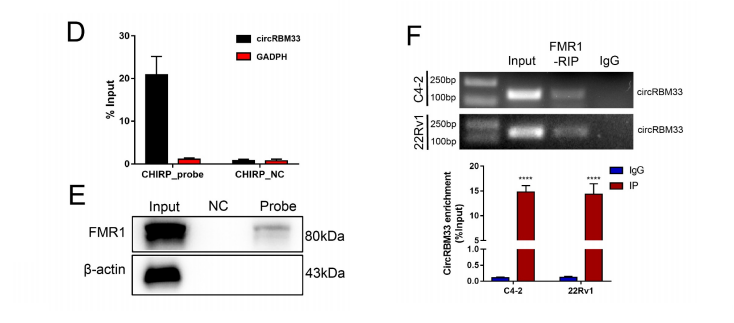
ChIRP检测,以锁定与circRBM33相互作用的分子。
同时,研究团队进行了RIP检测,进一步证实了FMR1和circRBM33之间的分子结合。
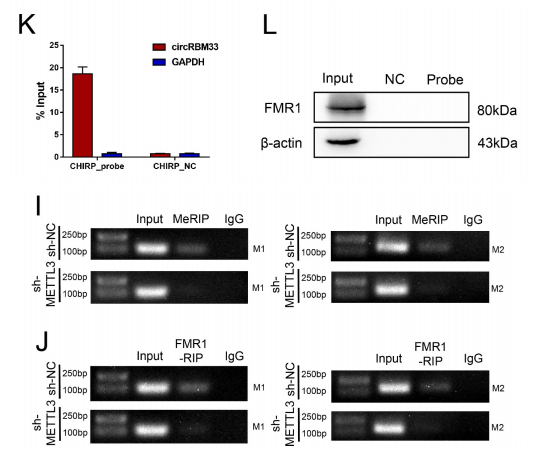
由于METTL3是m6A修饰中最重要的作者之一,研究团队进行了MeRIP检测,以检测METTL3基因敲低是否会减弱circRBM33 m6A的修饰。
METTL3参与了circRBM33的m6A修饰。
研究团队进行了FMR1-RIP检测,以确定METTL3是否参与了FMR1-circRBM33的相互作用。
此外,研究团队应用ChIRP实验验证了m6A在circRBM33和FMR1相互作用中不可或缺的作用,结果表明,敲除METTL3的表达显著阻碍了circRBM33对FMR1的下拉,circRBM33以m6A依赖的方式与FMR1相互作用。
研究团队还研究了FMR1在前列腺癌预后中的作用。
circRBM33高表达的PCa细胞的基础呼吸和最大呼吸能力均高于circRBM33低表达的PCa细胞。
这些结果表明,circRBM33促进PCa细胞生长和侵袭性的线粒体呼吸。
为了评估FMR1是否参与了PDHA1的调控,研究团队通过RIP检测证实circRBM33-FMR1复合物以m6A依赖的方式维持PDHA1 mRNA的稳定性。
在体内和体外,敲除circRBM33可增强PCa细胞对ARSI治疗的反应;在研究团队的研究中,研究团队验证了circRBM33/FMR1/ PDHA1调控轴参与了PCa细胞线粒体氧化磷酸化过程的增强,特别是在去势抗性细胞系中;在机制上,circRBM33以m6A的方式与FMR1相互作用,形成一个二元复合物,通过调节PDHA1来增强线粒体代谢。
此外,抑制circRBM33增加了CRPC细胞系中ARSI的抗肿瘤活性。


作者使用伯信生物明星产品MeRIP、RIP、ChIRP试剂盒进行了上述分子互作调控机制的研究。




