Tumor Cell Derived Lnc-FSD2-31:1 Contributes to Cancer-Associated Fibroblasts Activation in Pancreatic Ductal Adenocarcinoma Progression through Extracellular Vesicles Cargo MiR-4736 《RESEARCH ARTICLE》(IF=17.521)

胰腺导管腺癌(PDAC)死亡率高,总生存率短。
癌症相关成纤维细胞(CAFs)在PDAC中作为癌细胞的避难所。
CAFs与癌细胞之间的细胞内通信机制有待探索。
长链非编码RNA(lncRNAs)参与调节PDAC的肿瘤发生和肿瘤进展;然而,在肿瘤微环境中,特定的lncRNA及其作用机制尚未明确。
本研究旨在鉴定PDAC中参与癌细胞和CAFs之间细胞相互作用的新型 lncRNA。
为此,研究团队筛选了长期和短期生存的PDAC患者之间差异表达的lncRNA。
Lnc-FSD2-31:1在长期生存患者中显著增加。
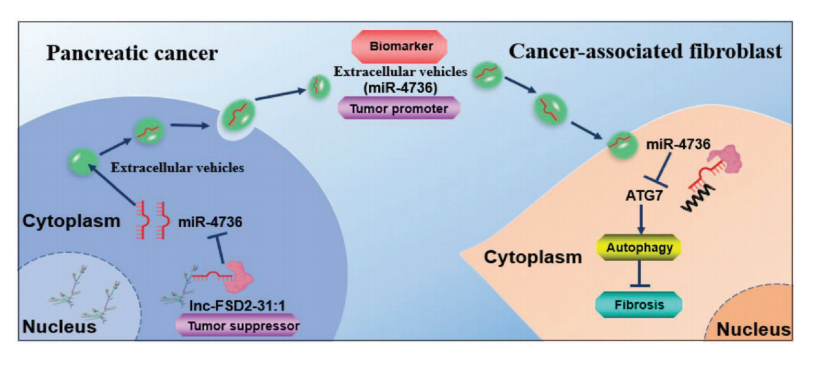
这项研究随后发现,肿瘤来源的lnc-FSD2-31:1通过细胞外囊泡(EVs)运输的miR-4736抑制CAFs的激活。
在机制上,EVs衍生的miR-4736抑制自噬,并通过靶向ATG7促进CAFs的激活。
此外,在基因工程KPC(LSL-KrasG12D/+、LSL-Trp53R172H/+和Pdx-1-Cre)的小鼠PDAC模型中,阻断miR-4736可抑制肿瘤生长。
本研究表明,瘤内lnc-FSD2-31:1调节CAFs的自噬,从而通过EVs衍生的miR-4736激活它们。
靶向miR-4736可能是PDAC潜在的生物标志物和治疗靶点。
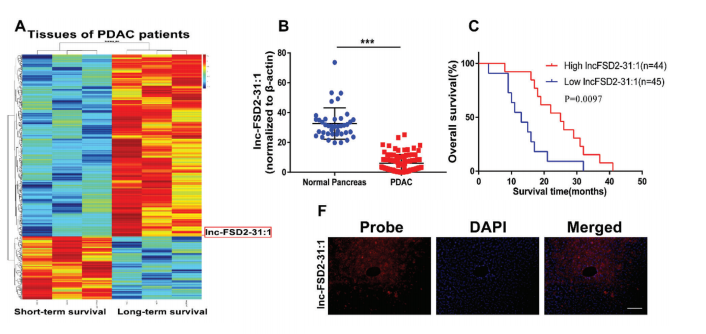
用转录组测序技术研究长期(>5年)和短期生存(<6个月)PDAC患者之间差异表达的lncRNAs,共鉴定出489个lncRNAs,研究团队发现一种与长期生存相关的lncRNA,名为lnc-FSD2-31:1,在肿瘤进展中尤为突出。
RNA荧光原位杂交(FISH)结果表明,lnc-FSD2-31:1定位于肿瘤细胞的细胞核和细胞质中;数据分析及体外实验发现肿瘤来源的Lnc-FSD2-31:1通过EVs抑制CAFs的激活;为了阐明lnc-FSD2-31:1与EVs之间的关系,研究团队检测了lnc-FSD2-31:1在EVs中的表达,发现这些结构中没有lnc-FSD2-31:1。
这一结果表明,癌细胞来源的EVs对CAFs的激活并不是通过lnc-FSD2-31:1的内吞作用来介导的。
前期的研究证实自噬与PDAC进展密切相关。
发现关键自噬基因ATG7的mRNA是最显著差异表达的。
研究团队假设lnc-FSD2-31:1可能通过ATG7调控CAFs中的自噬。
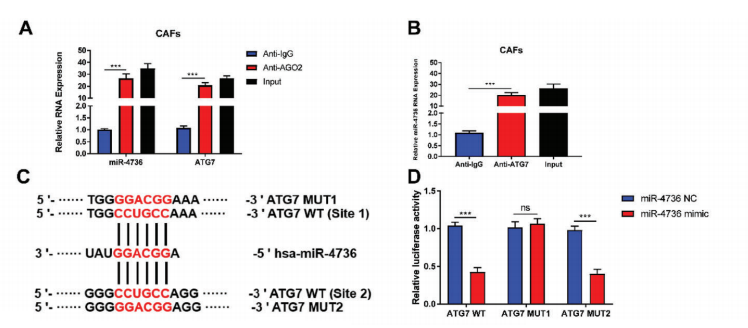
采用RNA免疫沉淀(RIP)试验和双荧光素酶报告试验,以确定miR-4736是否通过靶向ATG7激活CAFs。
数据显示,miR-4736和ATG7在抗 AGO2微球中明显富集,miR-4736抑制了自噬并激活了CAFs;研究团队引入溶酶体酸化和与自噬体融合抑制剂巴弗洛霉素A1来阻断LC-3溶酶体降解,并研究miR-4736-ATG7轴调控中是否存在自噬体积累。
结果表明miR-4736直接靶向ATG7,抑制CAFs中自噬小体的形成并激活纤维化。
为了探究lncFSD2-31:1对肿瘤生长的影响,在肿瘤细胞中,高水平的lnc-FSD2-31:1可以抑制肿瘤生长,而在CAFs中抑制ATG7可以挽救这些作用;转基因小鼠模型实验发现miR-4736抗他戈米尔通过激活自噬和失活CAFs来抑制肿瘤进展。
此外,研究团队从21例健康供体和15例PDAC患者的血浆中分离出EVs,PDAC患者的血浆EVs-miR-4736水平明显高于健康供体,这表明miR-4736可能是一种潜在的治疗药物和PDAC的预测目标。
总之,研究团队发现肿瘤来源的lnc-FSD2-31:1通过EVs衍生的miR- 4736调控CAFs的自噬和纤维化。
MiR-4736可能为PDAC诊断和治疗的潜在靶点。

作者使用伯信生物明星产品RIP试剂盒进行了上述分子互作调控机制的研究。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202203324




