《Journal of Nanobiotechnology》 (IF=10.2000)
背景
大多数卵巢癌接受铂类化疗(OC)患者由于耐药性预后较差。然而,在铂耐药的OC中,环状RNA(circRNA)和p53泛素化的调控机制尚不清楚。我们的目的是识别与铂耐药OC相关的环状rna,以开发一种新的治疗策略。
方法
通过circRNA测序筛选铂抗性环状rna,并在OC细胞和组织中使用定量逆转录PCR进行验证。采用Sanger测序、寡核igo(dT)引物、核糖核酸酶R和荧光原位杂交分析circNUP50的特征。
在体外和体内分别进行了功能实验研究。通过circRNA下拉分析、质谱、荧光素酶报告基因、RNA结合蛋白免疫沉淀、免疫荧光分析、环己酰亚胺追逐分析和泛素化实验,研究了circnup50介导的P53泛素化机制。最后,我们构建了一个铂和si-circNUP50共递送纳米系统(Psc@DPP),用于在原位动物模型中治疗铂耐药的OC。
结果
我们发现,circNUP50通过促进细胞增殖、破坏细胞周期和减少细胞凋亡来促进OC中的铂耐药条件。si-circNUP50 mRNA测序和circRNA下拉分析显示,circNUP50通过结合p53和UBE2T,加速p53泛素化,介导OC中的铂耐药性。
相比之下,miRNA测序和circRNA下拉实验表明,circNUP50可以作为miR-197-3p的海绵,从而上调G3BP1介导p53泛素化,促进OC铂耐药。Psc@DPP在OC肿瘤模型中成功地克服了铂耐药性,并为使用si-circNUP50治疗铂耐药卵巢癌提供了一个新的想法。
结论
本研究揭示了circNUP50通过调节p53泛素化来介导OC中铂耐药的一种新的分子机制,并为开发OC中铂耐药的有效治疗策略提供了新的见解。
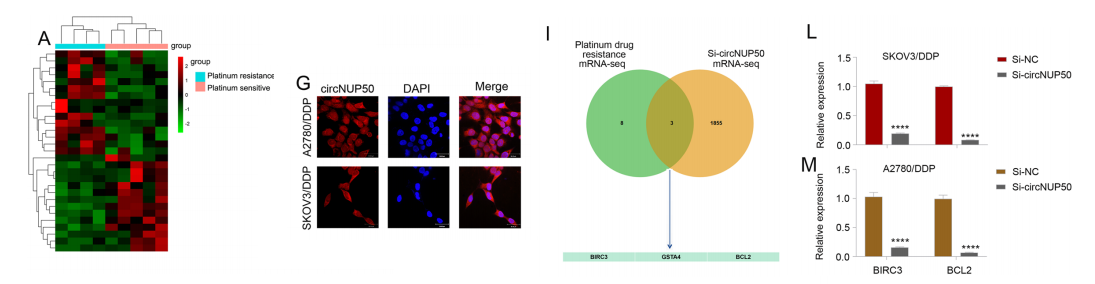
环状RNA测序发现29个环状rna在耐铂的OC和PS组织中存在差异。差异表达的环状rna与PI3KAkt信号通路、正向生长调控和正向自噬调控相关。circNUP50在细胞和组织中的表达存在显著差异。FISH检测circNUP50存在于细胞的细胞核和细胞质中。
从放线菌素D的表达情况来看,circNUP50比线性NUP50更稳定。qRT-PCR结果显示circNUP50在OC铂耐药组织和细胞中过表达。
mRNA-seq数据中circNUP50相关基因的异常表达与细胞色素P450药物代谢、铂耐药和MAPK激活调控密切相关。circNUP50的表达与生物过程和MAPK和p53信号通路中的正细胞周期调控相关。
我们评估了来自OC组织和si-circNUP50-SKOV3/DDP细胞的mRNA-seq数据,并鉴定了三种铂类耐药mrna,BIRC3、GSTA4和BCL2,它们的功能是通过circNUP50介导的。SKOV3/DDP(A2780/DDP细胞中BIRC3和BCL2的表达较高。此外,在转染了si-circNUP50的SKOV3/ DDP和A2780/DDP细胞中,BIRC3和BCL2的表达降低。这些结果表明,circNUP50可能通过BIRC3和BCL2调控OC中的铂抗性。
我们选择了si-circNUP50进行细胞功能实验。与对照组相比,下调CircNUP50的表达可降低SKOV3/DDP和A2780/DDP细胞的增殖活性、细胞周期阻滞在G0/G1期并增加了细胞的凋亡率。
随后,我们在体内验证了circNUP50在介导铂治疗耐药性中的作用。下调DDP耐药细胞显著降低了异种移植瘤生长,使细胞对DDP治疗敏感。这些研究表明,circNUP50通过促进细胞增殖、破坏细胞周期和减少细胞凋亡来促进OC中的铂耐药性。
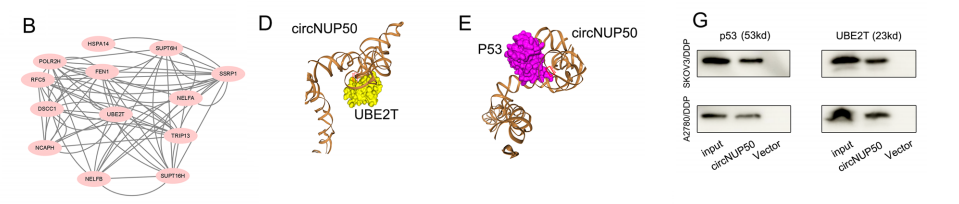
为了探索与circNUP50结合的蛋白,我们对RNA下拉产物,使用质谱(ChIRP-MS)对RNAbinding蛋白进行全面鉴定。circNUP50调控泛素化,并在OC的铂耐药性中发挥重要作用。ub偶联酶E2T(UBE2T)是结合蛋白中重要的泛素偶联酶。在接受含DDP方案治疗的OC患者中,高UBE2T表达与低OS显著相关。
RIP分析,以进一步表征circNUP50与UBE2T和p53的相互作用。TRAP-westen结果显示,p53和UBE2T可以与circNUP50-MS2结合。Co-IP显示p53和UBE2T可以相互结合。共定位实验表明,p53和UBE2T蛋白共定位于SKOV3/DDP和A2780/DDP细胞的细胞质中。
泛素化实验表明,在SKOV3/DDP中过表达UBE2T增强了p53的泛素化。circNUP50过表达也增强了p53的泛素化。因此,circNUP50可以同时结合p53和UBE2T,通过与UBE2T结合,调节p53泛素化,介导OC中的铂耐药性。
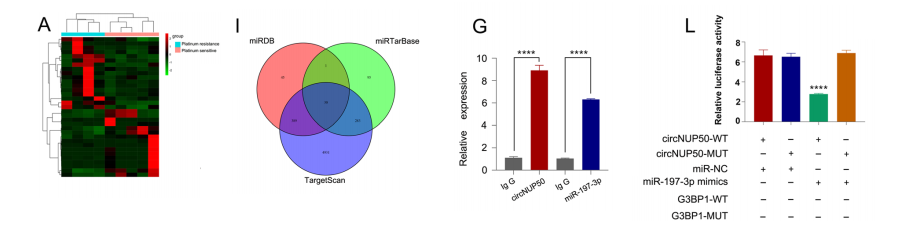
我们对铂耐药和PS OC组织进行了miRNA-seq分析,以研究mirna是否可以被circNUP50海绵化。数据表明只有miR-197-3p和miR-1296-5p可以与circNUP50结合。miR-197-3p在OC PS组织中表达较高,且在OC铂耐药组织中表达明显差异。基于circRNA下拉实验,miR-197-3p可以特异性地结合circNUP50。
RIP实验显示,与IgG组相比,Ago2组中circNUP50和miR-197-3p的富集量增加。RNA FISH实验显示,circNUP50和miR-197-3p在细胞质中共同定位。当过表达miR-197-3p时,SKOV3/DDP细胞和A2780/ DDP细胞增殖减少、被阻滞在细胞周期的G0/G1期以及细胞的凋亡率增加。
此外,anti-miR-197-3p的功能通过circNUP50水平的降低而得到挽救。此外,数据库结合si-circNUP50 mRNA-seq数据时,G3BP1和FRMPD3为靶基因。G3BP1的表达在对含铂治疗耐药的患者中更高,与对含铂治疗有反应的患者明显不同,FRMPD3的表达并没有显著差异。因此,G3BP1被鉴定为其下游靶基因。
荧光素酶报告基因检测结果显示,miR-197-3p可与circNUP50和G3BP1结合。这些实验表明,circNUP50可以作为miR-197-3p海绵,上调G3BP1,介导OC中的铂耐药性。
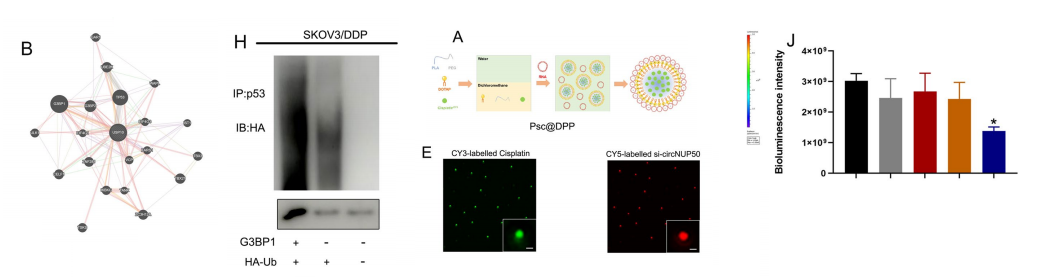
我们制备了铂和si-circNUP50共递送纳米系统(Psc@DPP),用于在原位动物模型中的铂耐药OC。同时构建了OC铂耐药原位动物模型,以探索Psc@DPP在体内潜在的抗肿瘤作用。
我们观察到,Psc@DPP组的荧光强度明显低于PBS组和铂组。HE染色显示,与其他组相比,Psc@DPP组的肿瘤面积减少。此外,我们还在体外细胞水平上探讨了Psc@DPP潜在的抗肿瘤作用。
在Psc@DPP实验组中,SKOV3/DDP和A2780/DDP细胞增殖减弱,细胞凋亡率增加。结果表明,Psc@DPP在OC肿瘤模型中有效地克服了铂耐药性,并提出了一种使用si-circNUP50治疗铂耐药OC的新方法。大多数OC患者获得DDP耐药,这是生存期短和预后不良的主要原因。因此,确定OC患者铂耐药的机制,发现新的分子治疗靶点来逆转铂耐药至关重要。
我们首先报道了circNUP50与OC中的铂耐药性相关,并通过与UBE2T结合来调节p53的泛素化。此外,circNUP50可以作为miR-197-3p海绵,通过上调G3BP1来调节p53泛素化,调节铂耐性。
Te构建的Psc@DPP共传递纳米体系可以处理OC中的铂电阻。我们的研究揭示了一种circNUP50通过调节p53泛素化来介导OC中铂耐药的新机制,这表明拮抗circNUP50的表达可能是克服OC中DDP耐药的治疗策略。

作者使用伯信生物明星产品TRAP、RIP试剂盒进行了上述筛选与分子互作调控机制的研究。




