Exosomal circZNF451 restrains anti-PD1 treatment in lung adenocarcinoma via polarizing macrophages by complexing with TRIM56 and FXR1《Journal of Experimental & Clinical Cancer Research》(IF=12.658)

背景:尽管少数晚期肺腺癌(LUAD)患者的治疗取得了成功,但在大多数LUAD患者中发现了抗程序性死亡1(PD1)耐药性。在这里,研究团队旨在揭示外泌体环状RNA在PD1阻断的LUAD中的潜在作用。
方法:采用circRNA测序和qRT-PCR以确定随后用抗PD1治疗的LUAD患者的外泌体环状RNA水平。然后,利用RNA下拉、RNA免疫沉淀、质谱、染色质免疫沉淀、荧光素酶报告分析、荧光细胞术、RNA测序和体内外模型,揭示circZNF451在LUAD抗PD1治疗耐药性中的生物学功能和潜在机制。
结果:circRNA测序和qRT-PCR发现,LUAD进展性疾病(PD)患者与PD1阻断治疗后部分缓解(PR)患者的外泌体circZNF451表达上调。此外,研究还发现circZNF451的升高与LUAD患者预后不良相关。此外,外泌体细胞circZNF451可在巨噬细胞中诱导抗炎症表型和细胞毒性CD8+ T细胞衰竭,并增强TRIM56介导的FXR1降解,从而激活巨噬细胞中的ELF4-IRF4通路。通过转基因小鼠,研究团队发现在巨噬细胞中敲除ELF4可以挽救具有高水平外泌体circZNF451的肿瘤的免疫治疗效果。
结论:外泌体circZNF451通过FXR1-ELF4-IRF4轴诱导巨噬细胞极化,重塑肿瘤免疫微环境,是预测PD1阻断在LUAD中的敏感性的一种新的生物标志物。
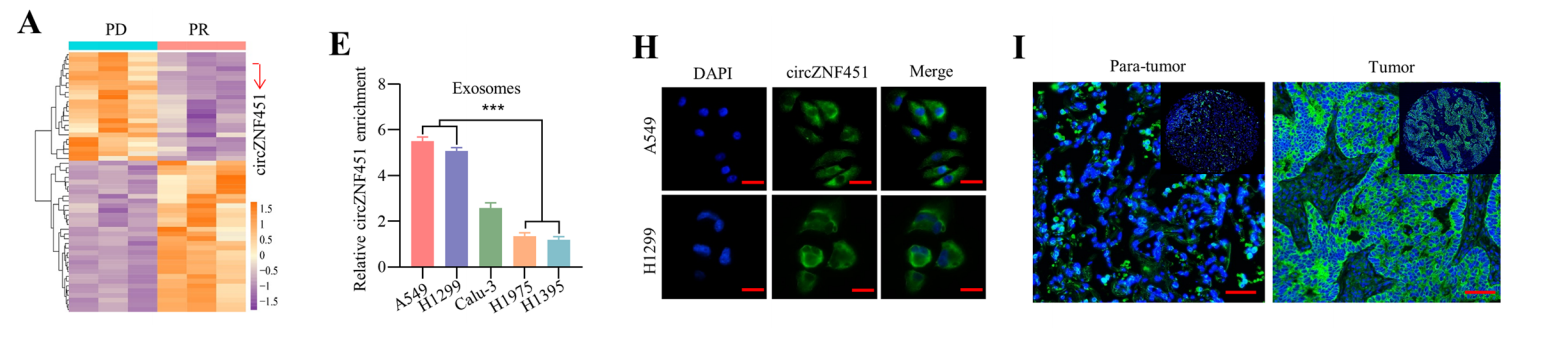
为研究外泌体环状RNA在免疫治疗耐药性中的潜在作用,研究团队对PD和PR患者进行了环状RNA测序;qRT-PCR检测活检肿瘤组织中的circZNF451,显示circZNF451在外泌体和肿瘤组织中的表达高度一致;Sanger测序鉴定了circZNF451的闭环结构。
此外,体外和体内实验表明,外泌体circZNF451可以诱导巨噬细胞的M2极化,重塑TME,限制抗PD1治疗的敏感性。
此外,研究团队还发现circZNF451通过E3连接酶TRIM56诱导RBP FXR1泛素化,从而激活巨噬细胞中的ELF4-IRF4通路。
重要的是,在巨噬细胞中条件敲除ELF4可以增强抗PD1在转基因小鼠高表达circZNF451的LUAD中PD1的表达。
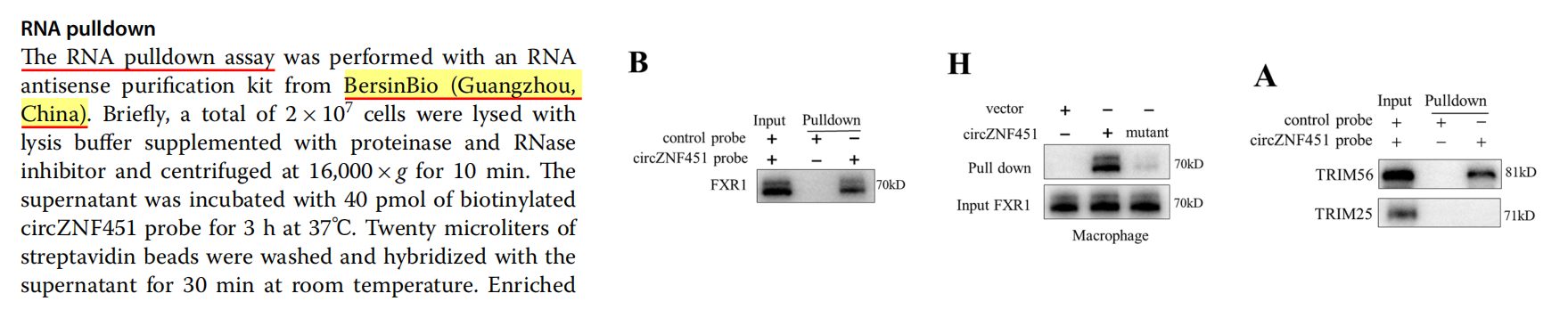
为了进一步探索这一点,研究团队用RNA pulldown、RIP等技术进行分子调控机制研究。
环状RNA可以作为microRNA的海绵。然而,RIP检测显示,circZNF451不能被AGO2富集,这表明circZNF451可能没有作为miRNA海绵的功能。
因此,研究团队进一步检测了circZNF451是否通过与蛋白质相互作用发挥作用。用生物素化的circZNF451探针在巨噬细胞中进行RNA pulldown实验,RNA下拉和RIP分析进一步确定了circZNF451和FXR1之间的特异性相互作用,提示circZNF451调控了FXR1蛋白的表达。
这些结果表明,LUAD衍生的外泌体circZNF451可能驱动巨噬细胞中FXR1的泛素化。circZNF451增强了TRIM56介导的FXR1泛素化,RNA下拉和RIP一致认为circZNF451可以与TRIM56特异性地相互作用,FXR1的降解激活了巨噬细胞中的ELF4-IRF4通路。
作者使用伯信生物明星产品RNA pulldown试剂盒进行了上述分子互作调控机制的研究。
原文链接:https://jeccr.biomedcentral.com/articles/10.1186/s13046-022-02505-z




