ECSIT Is a Critical Factor for Controlling Intestinal Homeostasis and Tumorigenesis through Regulating the Translation of YAP Protein《 Advanced Science》

摘要:
肠上皮是哺乳动物中更新最快的组织,必须严格控制其再生过程,以减少功能障碍和肿瘤发生的风险。yes相关蛋白(YAP)的有序表达和激活是驱动肠道再生的关键步骤,也是肠道内稳态的关键。
然而,控制这一过程的调控机制仍然在很大程度上是未知的。
本研究发现,Toll通路中进化上保守的信号中间体(ECSIT)是一种多功能蛋白,沿着隐窝-绒毛轴富集。
肠细胞特异性消融ECSIT导致肠分化异常,伴随着依赖翻译的YAP蛋白增强,从而将肠细胞转化为早期增殖的干细胞样细胞,增强肠肿瘤发生。
ECSIT的缺失导致代谢重编程,有利于氨基酸代谢,导致编码真核起始因子4F通路的基因去甲基化,其表达增加,进一步促进YAP翻译起始,最终导致肠道稳态失衡和肿瘤发生。
ECSIT的表达与结直肠癌患者的生存率呈正相关。综上所述,这些结果表明,ECSIT在调节YAP蛋白翻译以控制肠道内稳态和肿瘤发生中发挥了重要作用。
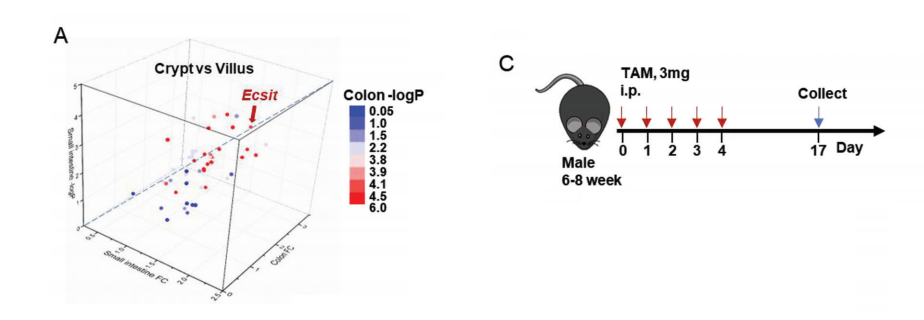
通过RNA-seq分析比较小鼠肠道隐窝和绒毛区域的基因表达谱,发现ECSIT是一种多功能蛋白,是隐窝和绒毛中上调最多的因子。
通过构建年龄匹配的雄性Ecsitfl/fl和Ecsitfl/flvillin-CreERT2(以下简称EcsitcKO)小鼠模型及功能实验,表明肠细胞中ECSIT缺失后肠分化的失调.
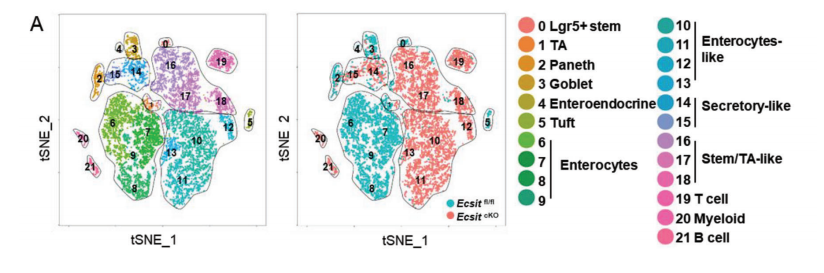
对ECSIT缺乏的肠细胞的单细胞测序数据显示,干细胞/TA细胞表达高,独特的早期增殖干细胞“样”细胞类型在cKO小鼠中大量出现,有趣的是,与这些“样”细胞的干细胞/TA细胞和分泌细胞相比,YAP靶基因如Ly6a、Ccnd2、Birc5、肠细胞、Cdk4和Anxa3的表达增强,并显示出显著更高的YAP程序和恢复干细胞特征,YAP是一种被Hippo参与了肠干细胞稳态的调节,对早期肠干细胞增殖和肠上皮再生至关重要。
然而,YAP蛋白的过表达会导致组织损伤时无法重新获得肠道内稳态,从而导致癌症的发展。使用蛋白质组学、蛋白印迹法和IF法分析了YAP蛋白的水平。
在ECSIT缺陷小鼠中都显示出显著升高的YAP蛋白水平、YAP程序和恢复干细胞信号,因此,ECSIT缺陷的肠细胞表现出早期增殖的干细胞“样”细胞类型,具有独特的YAP应答基因特征和再生特征,这与YAP蛋白的上调有关,而与其编码转录本无关。
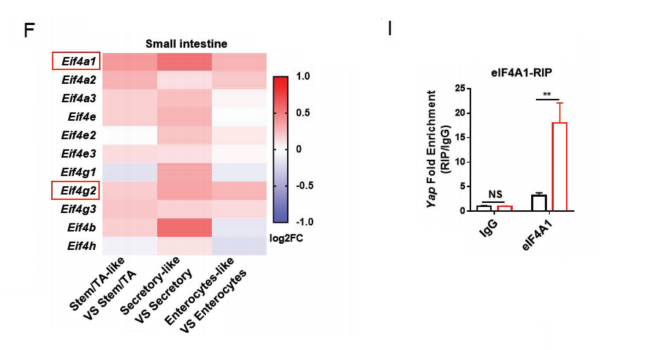
在cKO类器官中,YAP的核易位和典型的YAP靶基因的水平显著上调,为了进一步探索YAP蛋白水平升高的机制,我们深入分析了单细胞转录组数据,scRNAseq和IF数据均显示,与对照组相比,eIF4F成员,特别是eIF4A1,在cKO干细胞样细胞中显著上调,RNA免疫沉淀(RIP)分析证实了在cKO肠中,eIF4A1与5‘YapmRNA的结合显著富集。
上皮细胞中ECSIT缺失导致eIF4F水平升高,促进YAP翻译并将肠细胞转化为YA过表达干细胞样细胞的模型相一致。
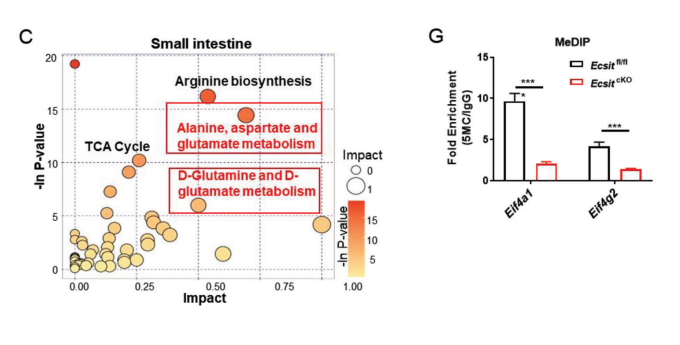
我们对cKO小鼠和对照小鼠的肠上皮细胞进行LC-MS/MS的代谢组学研究,主成分分析(PCA)显示了基于小肠和结肠两组的代谢谱清晰的聚类,发现cKO肠道中丙氨酸、天冬氨酸、天冬氨酸和谷氨酸代谢途径的代谢物显著丰富。
cKO肠的“样”细胞中谷氨酸代谢基因的表达也显著升高。高a-KG/琥珀酸比例被认为可以调节染色质修饰,包括10-11个易位(TET)依赖的DNA去甲基化,这有助于多能性相关基因的表达,以支持胚胎干细胞(ESC)的自我更新,同时抑制分化。CpG岛分析还显示eIF4A1和eIF4G2启动子区域含有丰富的CG位点,表明eIF4A1和eIF4G2的表达可能受到DNA甲基化的严格调控。
MeDIP实验证实在cKO肠道中编码eIF4A1和eIF4G2的基因的DNA甲基化水平显著降低。肠道中ECSIT的丢失导致了有利于氨基酸代谢的代谢重编程。
这导致了较高的a-KG:琥珀酸比例,诱导编码eIF4F成分的基因的DNA去甲基化,从而增加其YAP的表达和翻译,最终使肠细胞转化为早期增殖干“样”表型。
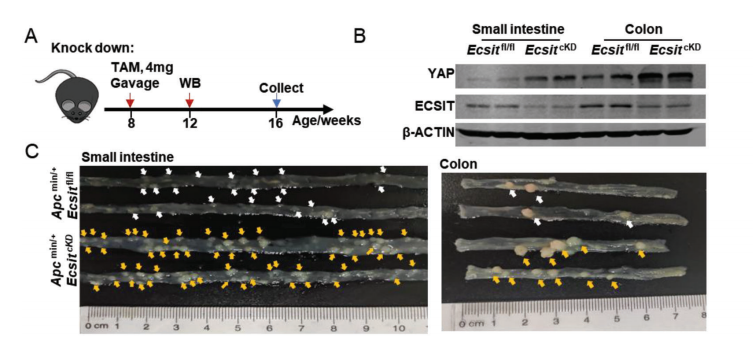
我们采用了一个诱导和条件敲除模型,允许长期探索ECSIT在肠道肿瘤发展中的作用,我们发现Apcmin/+ EcsitcKO类器官比Apcmin/+ Ecsitfl/fl类器官大得多,并表现出更高的YAP表达,YAP抑制剂和eIF4F抑制剂显著降低了大小和YAP表达Apcmin/+ EcsitcKO肿瘤类器官,说明eIF4F-YAP轴在驱动ECSIT防御导致的致瘤表型中的作用。
ECSIT的表达与相关读患者的总生存率呈正相关,YAP的表达与蛋白质水平是负相关的生存患者,和患者的预后与ECSITlow YAPhigh表达,进一步支持我们的模型,ECSIT肠道肿瘤发生的监管机构通过控制YAP的蛋白质表达。总的来说,这些数据表明ECSIT作为肠道肿瘤发生的调节因子起着关键作用。
在本研究中,我们确定了ECSIT的一个新作用:它是肠道内稳态的关键调节因子,并对肿瘤发生提供保护,这一发现扩展了我们对ECSIT的认识。在这里,我们揭示了一个肠道肿瘤发生的关键机制,该机制是由ECSIT缺失驱动的,以eif4f介导的方式提高YAP蛋白的翻译水平。
研究解决了YAP蛋白表达在肠道分化早期如何调控这一重要的科学问题,并描述了多功能蛋白ECSIT在肠道稳态中的关键生理作用。此外,本研究还提供了一个分子框架,定义了ECSIT在调节YAP蛋白翻译以控制肠道肿瘤发生中的重要性。

作者使用伯信生物明星产品MeDIP和RIP试剂盒进行了上述分子互作调控机制的研究。
原文链接:https://pubmed.ncbi.nlm.nih.gov/37409430/




