Circular RNA encoded MET variant promotes glioblastoma tumorigenesis《 Nature Communications》
摘要:
受体酪氨酸激酶MET被其单一配体肝细胞生长因子(HGF)激活,在促进胶质母细胞瘤(GBM)干细胞的自遗传性、侵袭性和致瘤性中起着关键作用。然而,HGF/MET靶向治疗在GBM患者中显示出有限的临床益处,这提示了MET信号在GBM中的隐藏机制。
在这里,我们发现环状MET RNA(circMET)编码一个404个氨基酸的MET变体(MET404),由n6-甲基腺苷(m6 A)阅读器YTHDF2促进。circMET的基因消融可抑制小鼠中MET404的表达,并减弱MET信号传导。相反,小鼠星形胶质细胞中的MET404敲入(KI)+P53敲除(KO)可启动GBM肿瘤发生并缩短总生存期。
MET404直接与MET β亚基相互作用,并形成一个构成性激活的MET受体,其活性不需要HGF刺激。MET404高表达预示GBM患者预后不良,提示其临床相关性。通过中和抗体或基因消融靶向MET404可以降低GBM在体内外的致瘤性,并且通过添加传统的MET抑制剂可以获得组合效益。
总的来说,我们发现了一种促进GBM致瘤性的MET变异,为GBM患者,特别是那些MET过度激活的患者提供了一种潜在的治疗策略。
胶质母细胞瘤(GBM)是最常见的WHOIV级原发性脑癌,即使采用包括手术、放疗和化疗在内的多模式治疗,也几乎无法治愈。GBM表现出显著的瘤内异质性,具有多种遗传或表观遗传改变。CircMET是一种经过m6 A修饰的潜在编码circRNA。
我们对10个手术切除的GBM样本进行了RNA-seq和m6A-seq。与非m6a修饰的环状rna相比,m6a修饰的环状rna更可能由单个外显子产生,并且在癌组织中表达更高。我们对5个患者来源的GSCs和2个对照神经干细胞(NSCs)进行了核糖体新生链测序,以揭示具有编码潜力的环状rna。
为了进一步缩小GSCs中可翻译的环状RNA,我们接下来对GSC456和GSC23患者来源的GSCs进行了YTHDF2 RNA免疫沉淀测序(RIP-seq),并将数据与上述m6 A-seq和RNC-seq结果进行交叉引用。
我们鉴定了5个候选的环状rna,即circMET、circSPECC1、circXYLT1、circCDYL和circRBM33。鉴于MET在GBM肿瘤发生中的关键作用,我们将重点放在circMET(hsa_circ_0082002)上进行进一步研究。


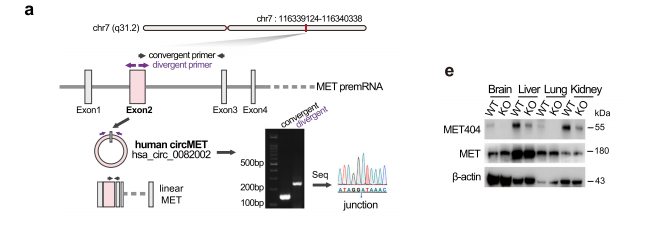
CircMET由hMET基因的第2外显子形成,使用与线性MET相同的起始密码子,在遇到终止密码子之前跨越后剪接连接位点,产生一个独特的四个氨基酸长的c端(INLS)。我们将这种未定义的蛋白命名为MET404,我们通过液相色谱/质谱(LC/MS)验证了MET404中100%的氨基酸。
为了进一步证实MET404是由circMET而不是MET线性剪接变体生成的,我们应用CRISPR/Cas9系统,CRISPR/cas9诱导的下游内含子元件缺失抑制了循环化效率,并显著降低了circMET水平。进一步表明circMET编码了该蛋白。
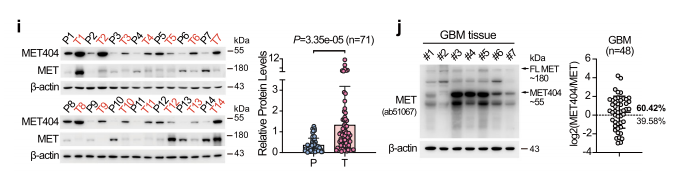
CircMET是一种m6a修饰的、YTHDF2相关的circRNA,YTHDF2是一种有效的GBM18高表达的胶质瘤预后标志物。YTHDF1/3的敲除并没有影响MET404的表达。对几个临床GBM样本和配对正常脑(NB)样本的检查显示,MET404倾向于在癌组织中过表达。与MET相比,MET404在一些GSCs和GBM癌组织中表达水平相当甚至更高。
MET404的高表达可能是由于circMET的半衰期较长,以及YTHDF2可识别出的富含的m6 A的修饰,有助于高效翻译。与来自临床手术肿瘤样本的cd133阴性细胞相比,cd133阳性细胞中circMET和MET404也表达上调。
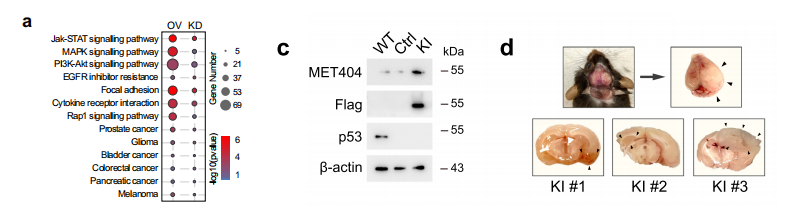
对干扰与过表达的GSC28细胞进行RNA-seq。KEGG富集分析,发现31条通路,包括几种受体酪氨酸激酶(RTK)相关通路和肿瘤相关通路,提示MET404参与了多种癌变信号通路。在GSC28细胞中,circMET RNA的OE或MET404 ORF的OE增加了p-MET和下游信号水平以及生物学功能。
在小鼠原位肿瘤发生实验中,MET404的KD抑制了小鼠脑肿瘤异种移植瘤的生长,延长了总生存期,而circMET RNA或MET404ORF(但不是circMET mut)的OE进一步增强了GBM的进展。以上结果表明,MET404通过激活MET信号通路对GBM肿瘤的发生至关重要。
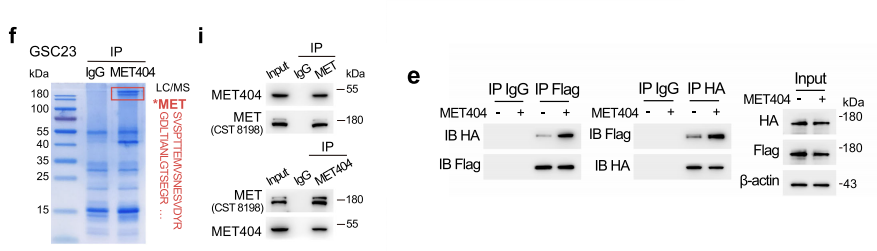
MET404激活的MET和下游信号传导,这些作用可以通过添加MET404中和抗体来拮抗(图5b,c),MET404通过MET受体发挥作用。我们进行了免疫沉淀-质谱(IP-MS),富集分析及reacome通路分析显示,MET404相互作用蛋白与RTK通路高度相关,特别是与MET信号通路相关,我们通过相互IP验证了GSC23细胞中MET404/MET的相互作用(图5i)。
以表达HA或标记的MET单体,并使用相应的标记抗体进行coIP检测,观察到不同标记的MET之间的相互作用(表明二聚体),并通过添加纯化的MET404得到加强(图6e)。为了进一步证明MET404诱导的二聚反应,我们应用了纳米比特系统。在MET外显子2KOGSCs中使用HGF或MET404处理并没有激活下游的p-AKT和p-ERK(图6g)。
这表明MET404可以在不受HGF刺激的情况下与β亚基形成复合物,激活MET受体(图6g)。考虑到MET404的异常表达,我们的数据表明,MET404是GBM中MET信号通路过度激活的关键激活因子。
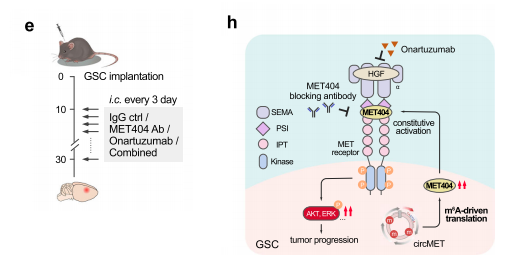
GBM临床样本中,发现MET404强度与p-MET水平相关。MET-404抗体的剂量依赖性添加逐渐降低了GSC23和GSC456细胞中的p-MET水平,提示了在GBM中靶向MET404的临床潜力。MET404抗体和奥纳妥珠单抗的联合使用,这是一种fda批准的MET信号通路抑制剂。
在小鼠脑肿瘤异种移植物中,奥纳妥珠单抗和MET404抗体治疗部分抑制了MET磷酸化和肿瘤进展;这两种方法的结合最大限度地抑制了GBM进展和体内MET信号传导,并将实验小鼠的总生存期延长到60天以上。总的来说,本研究确定了GBM中一个由circMET生成的分子靶点MET404。
作为一种先前未知的MET配体,MET404构成性地激活MET受体,刺激不依赖于HGF的下游效应因子,并驱动GBM的肿瘤发生。用单克隆抗体靶向MET404增强了抗HGF/MET治疗的疗效,强调一个可翻译的策略,以治疗关键淋巴结在脑恶性肿瘤。

作者使用伯信生物明星产品MeDIP和RIP试剂盒进行了上述分子互作调控机制的研究。
原文链接:https://pubmed.ncbi.nlm.nih.gov/37491377/




