
摘要:
肺癌是全球导致癌症相关死亡的主要原因。长链非编码rna(lncRNAs)已成为癌症发生发展的关键调控因子,并成为癌症诊断和预后的很有前途的生物标志物。在本研究中,我们发现了一种新的lncRNA(LINC02159),该基因在非小细胞肺癌(NSCLC)患者的肿瘤组织和血清中表达上调。我们发现,敲除LINC02159可以抑制NSCLC细胞的增殖、迁移和侵袭,但在体外诱导细胞凋亡和细胞周期阻滞,在体内延缓肿瘤生长,而过表达LINC02159则导致相反的效果。
通过转录组学分析,我们发现LINC02159与肿瘤的生长和转移相关通路高度相关,并且YAP1是LINC02159的潜在靶基因。在机制上,LINC02159与Aly/ REF输出因子(ALYREF)结合,通过m5 C修饰增强YAP1信使RNA(mRNA)的稳定性,导致NSCLC细胞中YAP1的过表达和Hippo和β-连环蛋白信号通路的激活。救援实验表明,LINC01259以YAP1-和ALYREF依赖的方式促进了NSCLC的进展。
综上所述,LINC02159通过调控ALYREF/YAP1信号通路在NSCLC进展中发挥致癌作用,有可能作为NSCLC的诊断标志物和治疗靶点。
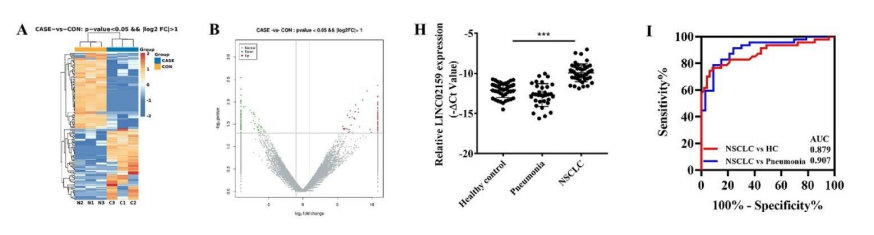
研究团队使用NSCLC患者中匹配的肿瘤组织和邻近的非肿瘤组织进行了RNA测序。RNA测序结果显示,肿瘤组织中有84个lncRNAs上调,89个lncRNAs下调。我们选择了LINC02159进行进一步的研究,因为它到目前为止还没有在癌症中进行研究。
我们证实,与HBE细胞相比,人NSCLC细胞系(A549、H1299和PC9)中LINC02159的表达上调。qRT-PCR结果显示,LINC02159在72%的肿瘤组织中的表达水平高于邻近非肿瘤组织。与肺炎患者和健康个体相比,NSCLC患者血清中LINC02159的表达显著上调。
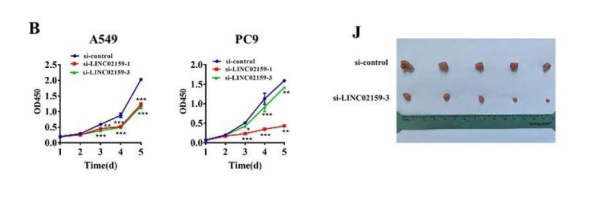
为了揭示LINC02159在NSCLC中的生物学功能,我们进行了功能缺失研究,下调LINC02159显著抑制了NSCLC细胞的增殖(图2b和C)。在NSCLC细胞中下调LINC02159可诱导凋亡细胞数量增加。为了进一步验证LINC02159在NSCLC进展中的作用,我们建立了体内小鼠皮下异种移植瘤模型。
我们发现,LINC02159基因敲低组的小鼠肿瘤的体积和体重均小于对照组(图2J)。LINC02159基因敲低组小鼠肿瘤组织中增殖的肿瘤细胞数量减少,凋亡细胞数量增加(图2K)。
另外下调LINC02159基因提高了NSCLC细胞对DDP/5-FU处理的敏感性。LINC02159基因敲低降低了吉非替尼和厄洛替尼的半抑制浓度值。这些结果表明,LINC02159在NSCLC的进展中发挥了致癌作用。
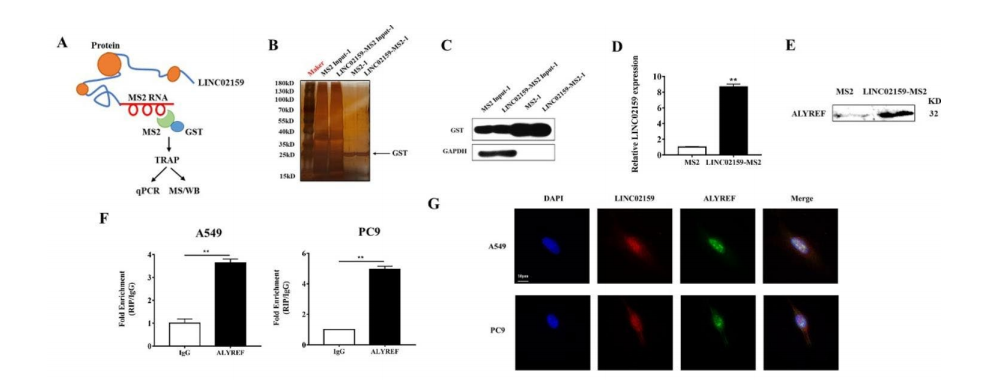
为了了解LINC02159在NSCLC中的致癌作用机制,我们进行了TRAP实验来鉴定与LINC02159相互作用的蛋白,因为它已被证明主要定位于细胞核(图3A-D)。质谱分析结果显示,与MS2组相比,LINC01259-MS2组中富集了几种蛋白。
我们选择了ALYREF来进行下面的研究,因为它有最高的倍数变化。我们通过另一种独立的TRAP检测方法验证了LINC01259和ALYREF的结合(图3E)。RIP检测结果证实,LINC02159在NSCLC细胞中的ALYREF-免疫沉淀复合物中富集(图3F)。我们分析了ALYREF蛋白在NSCLC患者的肿瘤组织和非肿瘤组织中的表达,发现ALYREF蛋白为在93%的肿瘤组织中高表达,同时升高的肿瘤组织中高表达(图3L)。
这些发现表明,LINC02159可能通过与ALYREF相互作用在NSCLC中发挥促肿瘤作用。
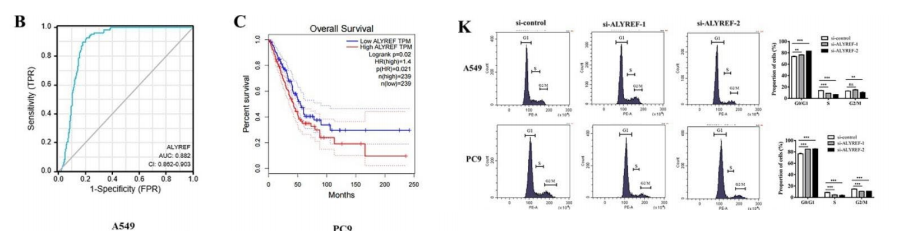
LYREF作为m5 C修饰的解读器,调节mRNA的加工和核输出。TCGA数据分析结果显示,与非肿瘤组织相比,NSCLC患者肿瘤组织中ALYREF显著上调,生存时间分析结果显示,高水平的ALYREF预示着NSCLC患者的整体预后较差(图4C)。
ALYREF敲低降低了NSCLC细胞的增殖、迁移和侵袭,并诱导了细胞凋亡和细胞周期阻滞(图4D-K)。ALYREF基因敲低增加了e-钙粘蛋白的表达,而降低了n-钙粘蛋白和波形蛋白以及Slug和Snail等EMT转录因子的表达(图4M)。
此外,ALYREF敲低不仅提高了NSCLC细胞对DDP/5-FU处理的敏感性,而且还降低了吉非替尼和厄洛替尼的半抑制浓度值(图S3)。这些结果表明ALYREF在NSCLC中上调,并作为致癌基因促进NSCLC进展。
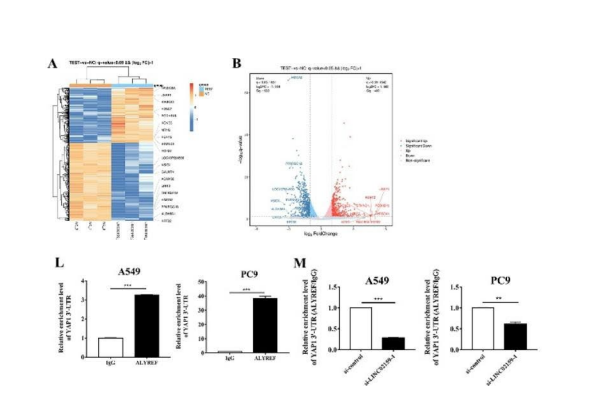
我们想了解在NSCLC中受LINC02159调控的下游基因和信号通路。采用RNA测序方法分析LINC02159敲低的NSCLC细胞中改变的基因。KEGG富集分析结果显示,LINC02159基因敲低影响了许多与癌症相关的通路,我们将重点放在YAP1上,因为下调LINC02159降低了其在NSCLC细胞中的基因表达(图5E)。
既往研究表明,YAP与TEAD转录因子相互作用,qRT-PCR检测了LINC02159和ALYREF敲低对这些靶基因的影响。结果显示,与对照组相比,在LINC02159-、ALYREF-和yap1-敲低组中,Hippo通路靶基因的表达显著降低,表明LINC02159通过YAP1调控TEAD活性(图5j、K、S7)。
然后,我们通过使用一对针对ALYREF的3‘-UTR结合位点的引物来确定ALYREF和YAP1 mRNA的相互作用。RIP结果显示,在NSCLC细胞中,YAP1 mRNA在ALYREF-免疫沉淀复合物中富集(图5L)。这些结果表明,LINC02159通过ALYREF介导的m5 C修饰调控YAP1 mRNA的表达和稳定性。
以往的研究表明,YAP1不仅作为转录共激活因子参与Hippo通路,而且作为Wnt/β-连环蛋白信号通路的关键调控因子。KEGG富集分析结果显示,linc02159敲除组中Wnt/β-连环蛋白信号通路显著富集(图6A)。与对照组相比,其表达量有所增加在LINC02159和ALYREF-敲低组中,β-连环蛋白、c-Myc和细胞周期蛋白D1的表达显著降低,而LINC02159的过表达导致了相反的效果(图6B-D)。
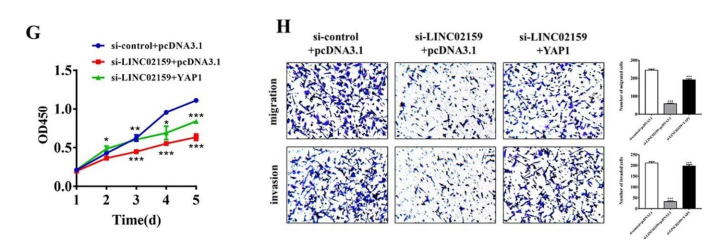
过表达ALYREF可以逆转LINC02159敲低导致的YAP1的下调(图6e和S7)敲除LINC02159明显抑制了YAP1的表达以及NSCLC细胞的生长、迁移和侵袭,但这种抑制作用可以逆转(图6G-H)。这些结果表明,LINC01259通过YAP1/β-连环蛋白轴促进NSCLC的进展。
LINC02159与ALYREF的相互作用通过增强YAP1的m5 C修饰,提高了其mRNA的稳定性,增加了其表达,激活了下游的Hippo和β-连环蛋白通路,促进NSCLC细胞的生长和转移。我们的研究结果阐明了LINC02159的生物学作用及其在NSCLC进展中的作用机制,这可能有助于我们更好地研究了解LINC02159在NSCLC发病机制中的作用,并为NSCLC提供了一个很有前途的生物标志物和治疗靶点。
作者使用伯信生物明星产品MeDIP和RIP试剂盒进行了上述分子互作调控机制的研究。
原文链接:https://pubmed.ncbi.nlm.nih.gov/37537569/




