Targeting cTRIP12 counteracts ferroptosis resistance and augments sensitivity to immunotherapy in pancreatic cancer
(IF=15.8000)
《Drug Resistance Updates》
摘要
目的:
目前胰腺导管腺癌(PDAC)的治疗策略在提高患者生存率方面效果有限,主要原因是铁死亡抵抗和免疫抑制。本研究旨在识别与PDAC肿瘤细胞中铁死亡抵抗和免疫抑制相关的分子机制。
方法:
对临床样本进行环状RNA测序(circRNA-seq),以鉴定可能介导铁死亡抵抗的潜在环状RNA,采用C11-BODIPY染色、FerroOrange染色、谷胱甘肽比值、丙二醛定量和透射电子显微镜评估铁死亡。
采用RNA下拉、质谱分析、RNA免疫沉淀和共免疫沉淀等方法,研究了其分子机制,并利用HuNSG小鼠异种移植瘤模型验证了治疗药物。
结果:
在对铁死亡有抗性的PDAC样本中鉴定出一种源自TRIP12的环状RNA(cTRIP12)。敲低cTRIP12增加了PDAC细胞对铁死亡和免疫治疗的敏感性。
随后的机制研究显示,cTRIP12特异性地与O-连接N-乙酰葡萄糖胺转移酶(OGT)蛋白结合,增加细胞内O-连接葡萄糖胺化水平,导致肿瘤细胞中铁蛋白重链(FTH)和PD-L1的蛋白水平升高。
值得注意的是,高表达的cTRIP12通过与OGT和蛋白激酶R样内质网激酶(PERK)相互作用,作为蛋白质支架抑制铁死亡敏感性并增强PDAC细胞的免疫抗性。
cTRIP12抑制通过降低FTH和PD-L1表达诱导PDAC细胞发生铁死亡,并协同提高免疫治疗效果。体内动物实验证实,由GSK2656157、erastin和抗CTLA-4组成的三联疗法可有效抑制高cTRIP12表达肿瘤中PDAC的进展。
结论:
我们阐明了PDAC患者铁死亡抵抗和免疫抑制同时发生的分子机制。本研究提供了一种新的治疗策略,可以促进肿瘤细胞的铁死亡,提高免疫治疗的效果。
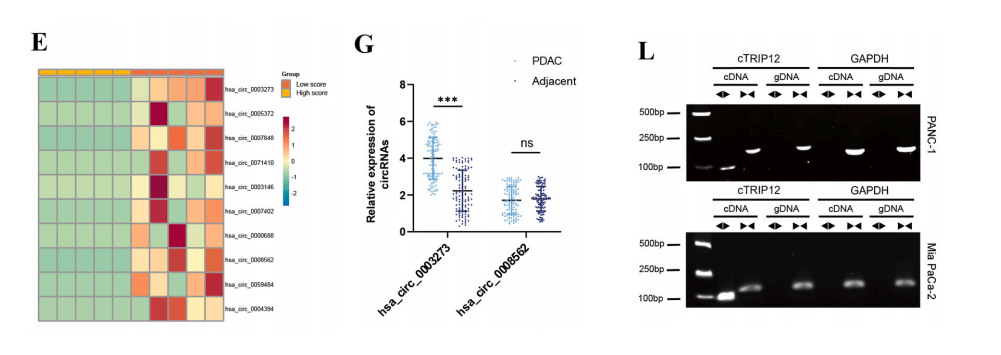
我们从117名被诊断为PDAC的患者中收集了样本。将患者分为铁死亡敏感组(高分组)和铁死亡抵抗组(低分组)。结果显示,铁死亡抵抗组患者的预后显著较差于铁死亡敏感组患者,表明铁死亡可能在PDAC中起重要作用。
为了识别与PDAC中铁死亡抵抗相关的环状RNA,我们选择了部分差异显著样本进行环状RNA测序。发现只有两种环状RNA(hsa_circ_0003273和hsa_circ_0008562)与铁死亡抵抗有关,其中hsa_circ_0003273的上调更为显著。
此外,PDAC组织中hsa_circ_0003273的表达量高于邻近组织。hsa_circ_0003273水平是PDAC的独立预后因素,并与铁死亡评分呈负相关。因此,我们将研究重点放在源自TRIP12的hsa_circ_0003273上。
我们随后验证了cTRIP12在不同PDAC细胞系中的表达。结果发现,Mia PaCa-2和PANC-1细胞中cTRIP12的表达量较高。cTRIP12仅通过不同的引物从cDNA中扩增,而未从gDNA中扩增。
此外,FISH和核质分离实验,我们发现cTRIP12主要定位于细胞质中。我们使用RNase R和放线菌素D验证了cTRIP12的稳定性。
此外,经放线菌素D处理后,cTRIP12比线性TRIP12 mRNA更稳定。总体而言,这些结果证实了cTRIP12在促进PDAC癌症中起作用,并且与铁死亡抵抗有关。

为了评估cTRIP12在PDAC中的作用我们构建了稳定过表达或敲低cTRIP12的PDAC细胞系;随后,我们评估了铁死亡诱导剂erastin对两种稳定转染细胞系的杀伤效果,发现sh-cTRIP12组的半最大抑制浓度(半抑制浓度)低于sh-NC组,而cTRIP12过表达则产生了相反的效果。
透射电子显微镜结果显示,sh-cTRIP12组的线粒体大小减小,膜密度增加,嵴减少甚至消失,而cTRIP12过表达组的线粒体未表现出明显的铁死亡迹象。
此外,研究结果表明,在sh-cTRIP12组中,脂质过氧化、Fe2+浓度和MDA表达增加,而GSH/ GSSG比值降低,提示铁死亡增加。相反,在cTRIP12过表达组中观察到显著的铁死亡抑制。
这些结果表明,cTRIP12抑制铁死亡,且cTRIP12表达下调促进铁死亡。
我们还研究了cTRIP12是否影响PDAC细胞的增殖。通过微肿瘤球体、3D肿瘤微球体坏死分析和CCK-8实验的结果显示,erastin处理时,cTRIP12的过表达增加了肿瘤细胞的增殖;而cTRIP12的敲低则减弱了这一效应。
皮下肿瘤发生结果进一步证实了这一发现。此外,我们使用高滴度cTRIP12敲低慢病毒建立了患者来源的类器官(PDO)模型,并发现与sh-NC处理相比,cTRIP12的敲低显著抑制了PDOs的生长和活性。
这些结果表明,cTRIP12通过抵抗铁死亡影响PDAC肿瘤的进展。
我们随后探讨了cTRIP12促进铁死亡抗性的机制。首先用多种死亡途径的激动剂处理细胞,包括凋亡、坏死和焦亡,发现只有厄司汀强烈诱导了肿瘤细胞死亡。
我们评估了包括GPX4和SLC7A11在内的六种分子的mRNA和蛋白水平。与对照组相比,这六种分子的mRNA水平没有显著变化,只有FTH蛋白的表达受到cTRIP12表达状态的影响。
随后,我们干扰了稳定转染sh-cTRIP12和过表达cTRIP12的Mia PaCa-2和PANC-1细胞中的FTH表达。
我们发现,线粒体收缩、膜密度增加、嵴减少或消失,以及脂质过氧化水平的变化、Fe2+和MDA因cTRIP12表达增加而引起的变化,通过敲低FTH得以逆转,表明cTRIP12敲低抑制了由FTH过表达引起的铁死亡抗性。
同样,通过使用另一种细胞系Mia PaCa-2,我们确认cTRIP12过表达导致的铁死亡抵抗性可以通过FTH敲低来逆转。
这些结果表明FTH是cTRIP12在PDAC细胞中铁死亡调控中的关键分子,cTRIP12通过FTH影响细胞对铁死亡的敏感性。
体外实验和体内实验均证实,cTRIP12过表达导致的PDAC细胞系肿瘤生长能力增强,在FTH沉默后得到了抑制。
这些结果表明,cTRIP12通过FTH抑制PDAC肿瘤中的铁死亡,并影响肿瘤的增殖。
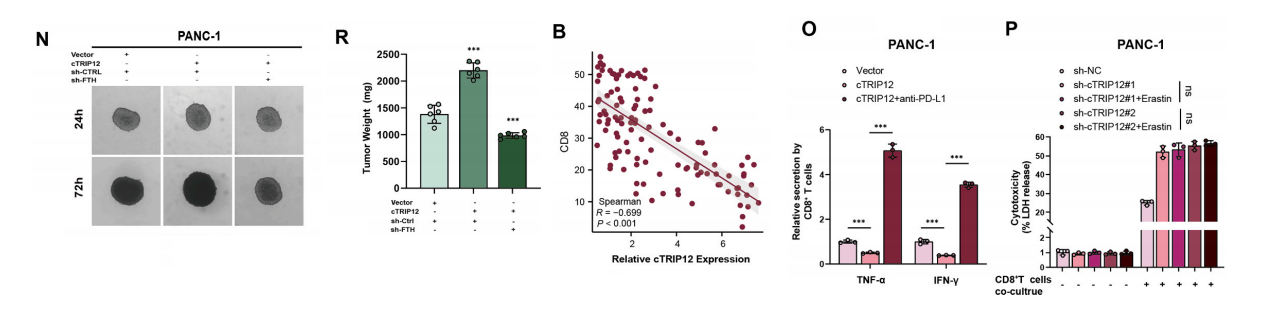
先前的研究表明,肿瘤细胞中的铁死亡通常伴随着肿瘤免疫微环境的变化。我们评估了cTRIP12对CD8+ T细胞浸润丰度的影响。
我们发现,在cTRIP12表达高的样本中,CD8+ T细胞的浸润较低,而在低表达组中则相反。因此,高表达cTRIP12可能减弱CD8+ T细胞在肿瘤组织中的浸润。
我们将活化的T细胞直接和间接地与稳定转染的Mia PaCa-2和PANC-1细胞共培养,然后分析相关的免疫标志物。
当cTRIP12过表达时,T细胞的杀伤能力显著受到抑制;而cTRIP12表达的抑制则导致IFN-γ和TNF-α的分泌水平显著增加,表明cTRIP12的抑制促进了对CD8+ T细胞的细胞毒性作用。
然而,cTRIP12的变化并未影响T细胞的趋化能力。我们通过向免疫缺陷NSG小鼠中引入人外周血单核细胞(PBMCs),建立了人源化的免疫系统。
沉默cTRIP12后,PDAC异种移植瘤的生长显著受到抑制,而cTRIP12过表达则促进了PDAC异种移植瘤的增殖。
免疫组化结果证实,沉默cTRIP12后,MDA和4HNE的表达水平显著增加,肿瘤细胞中的铁死亡水平升高,CD8+ T细胞的浸润增加;而cTRIP12过表达则降低了肿瘤中MDA和4HNE的表达以及CD8+ T细胞中的表达。
IHC染色结果表明肿瘤中PD-L1的表达受cTRIP12水平的影响。因此,我们推测cTRIP12通过影响PD-L1来介导肿瘤免疫的变化。
随后,我们阻断了PD-L1,以确定cTRIP12是否通过PD-L1影响机体的杀伤能力。结果表明,加入抗PD-L1抗体部分逆转了cTRIP12过表达导致的T细胞杀伤能力下降。
总体而言,我们的结果揭示了cTRIP12对PDAC免疫杀伤的影响是通过PD-L1的表达实现的。
我们还考察了cTRIP12诱导的免疫能力变化是否与铁死亡抵抗有关。与对照组相比,铁死亡激动剂厄司汀对沉默cTRIP12的细胞系中T细胞杀伤能力和细胞毒性效应没有显著影响,IFN-γ和TNF-α的分泌也没有明显受限。
这些发现表明,cTRIP12并不会通过铁死亡抵抗性损害T细胞的杀伤功能;相反,存在另一种途径。总之,我们的研究结果表明,cTRIP12可以降低PDAC中的免疫能力,而cTRIP12引起的铁死亡抵抗性和免疫能力的变化之间没有因果关系。
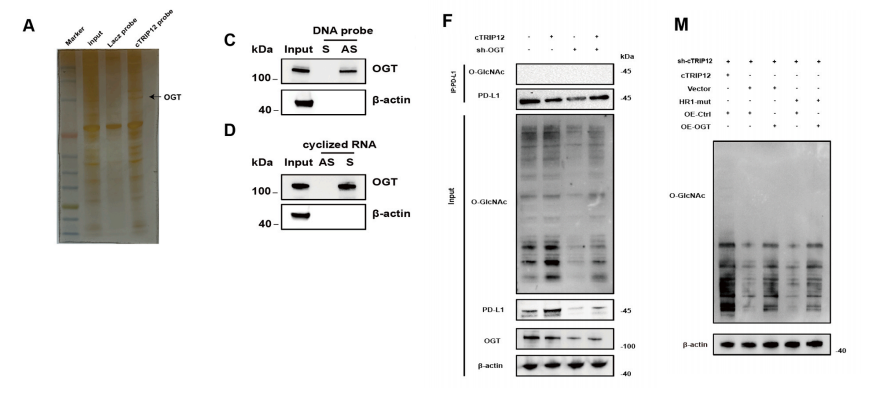
我们随后研究了cTRIP12如何同时影响铁死亡和肿瘤免疫微环境。我们使用cTRIP12下拉产物进行了银染,并通过RNA下拉-质谱法全面鉴定与cTRIP12结合的蛋白质。
O-糖基转移酶OGT因其高结合得分引起了我们的关注,它在调控蛋白质表达和稳定性方面发挥着关键作用。
RIP和RAP实验结果显示,cTRIP12能够完全结合到OGT上,免疫荧光共定位结果进一步证实了这一点。在过表达cTRIP12的细胞系中,发现FTH和PD-L1的表达确实受到cTRIP12和OGT的共同调控。
我们探索了cTRIP12与OGT的结合位点。为了确定cTRIP12与OGT之间结合所必需的区域,我们进行了带有生物素标记的cTRIP12突变体的RNA下拉实验。
我们观察到,cTRIP12中HR1的突变消除了cTRIP12与OGT之间的结合。后续的体外细胞实验验证了这些发现。我们发现,HR1的消除增加了肿瘤细胞中的铁死亡水平,并促进了体外肿瘤细胞的增殖。
这些结果表明,cTRIP12与OGT的结合发生在HR1上,并且对于PDAC的进展至关重要。
我们研究了cTRIP12是否通过影响O-连接GlcNAc化来调节FTH和PD-L1的蛋白表达。
我们发现,cTRIP12敲低降低了FTH和PD-L1的表达,而OGT过表达显著恢复了这两种蛋白质的水平。相反,OGT沉默显著逆转了cTRIP12过表达引起的FTH和PD-L1蛋白水平的增加。
我们用不同cTRIP12表达水平的细胞系分别处理了O-糖基化激动剂TMG和O-糖基化抑制剂OSMI-1。
实验结果证实了我们的假设,即TMG显著恢复了因cTRIP12表达沉默导致的FTH和PD-L1蛋白水平下降,而OSMI-1则产生了相反的效果。
我们的研究结果表明,PD-L1本身并不影响O-糖基化水平;然而,实验结果表明PD-L1受到O-糖基化水平的影响。
因此,O-糖基化对PD-L1表达水平的调控可能是由于其他潜在机制。我们分别用溶酶体降解抑制剂(CQ)和激动剂(雷帕霉素)处理了cTRIP12敲低和过表达细胞系。
结果表明,CQ治疗逆转了cTRIP12基因敲除导致的PD-L1下调,而雷帕霉素抑制了cTRIP12基因过表达引起的PD-L1上调。
随后,我们建立了异位表达PD-L1的PANC-1细胞系,以进一步研究cTRIP12介导的PD-L1调控。
在表达PD-L1的PANC-1细胞中,cTRIP12敲除显著增强了PD-L1与这些区室标志物的共定位信号,而cTRIP12过表达则减弱了这些信号。
这些发现证实了cTRIP12通过抑制PD-L1的溶酶体降解来调节其表达。沉默cTRIP12降低了HGS的O-连接GlcNAc化水平,从而减少了PD-L1的表达;而cTRIP12的过表达则增加了HGS的O-连接GlcNAc化水平,导致PD-L1表达上调。药理学验证进一步证实了这一发现。
上述实验结果表明,cTRIP12通过影响HGS的O-连接GlcNAc化水平来改变PD-L1的表达水平。最后,在转染了HR1-mut质粒的细胞中,FTH和HGS的OGlcNAc化水平显著降低,FTH和PD-L1的胞内蛋白水平也趋于下降。
总之,这些结果表明cTRIP12通过改变PDAC细胞内的OGlcNAc化水平影响FTH和PD-L1的蛋白水平,这一效应是通过其与OGT的结合介导的
接下来,我们研究了cTRIP12如何通过与OGT结合来调节O-连接的N-乙酰葡萄糖胺化。鉴于OGT是一种重要的修饰酶,其活性变化可能会影响细胞内O-连接的N-乙酰葡萄糖胺化的水平。
因此,我们推测cTRIP12通过改变OGT的活性来影响O-连接的N-乙酰葡萄糖胺化水平。我们的结果显示,在过表达cTRIP12后,OGT的总体磷酸化水平增加,而沉默cTRIP12则产生了相反的效果。
我们回顾了之前的质谱结果,并重点关注了相关的磷酸化激酶,其中磷酸化激酶PERK引起了我们的注意。
结合之前的实验结果,我们推测cTRIP12可能作为蛋白质支架促进PERK和OGT的结合。我们验证了cTRIP12与PERK的结合,RIP和RAP实验的结果完全证实了它们的结合。
荧光共定位的结果证实了cTRIP12与PERK在细胞内的空间关系。共免疫沉淀验证了cTRIP12在PERK和OGT之间的桥梁作用。
在过表达PERK的PANC-1细胞中,我们构建了三种磷酸化缺陷突变体:OGT-S20A、OGT-Y844F和OGT-Y976F。
后续验证表明,只有Ser20突变显著减弱PERK对OGT的磷酸化,证实PERK主要在Ser20处磷酸化OGT。
为了验证cTRIP12与PERK的结合位点,我们使用上述五个突变片段进行了FLAG pulldown实验。结果显示,HR3的突变消除了与PERK的结合。
OGT的磷酸化水平和细胞内O-GlcNAc化合物的水平显著改变。我们在cTRIP12沉默的细胞中验证了这些结果,并报告cTRIP12敲低降低了p-OGT的水平,FTH和HGS的O-GlcNAc化合物水平显著下降,而FTH和PD-L1的蛋白表达也有所减少。
这一现象通过过表达PERK得以逆转。同样,药物干预的结果与基因干预的结果一致,表明cTRIP12在PERK激活OGT酶活性的过程中充当蛋白质支架。
我们先前的实验结果证实,cTRIP12通过PERK/OGT轴调节O-糖基化,从而影响FTH和PD-L1的表达。
我们的研究结果表明,对于cTRIP12表达较高的患者,使用PERK抑制剂(GSK2656157)可能具有潜在的治疗效果。为了验证这一假设,我们构建了一个HuNSG小鼠异种移植瘤模型。使用抗PD-L1抗体并未显著提高体内治疗效果。
我们评估了体内联合使用抗CTLA-4疗法是否可行。我们将稳定表达cTRIP12的Mia PaCa-2细胞植入每只小鼠的左腹,小鼠被随机分配到五种治疗组。我们在肿瘤形成后一周开始不同的治疗方案。
四周治疗期结束后,切除皮下肿瘤并进行分析,结果显示,与生理盐水治疗相比,单独使用GSK2656157具有一定的抗肿瘤效果,而GSK2656157与铁死亡促进剂厄司汀联合使用则进一步抑制了肿瘤生长。
GSK2656157、erastin和抗CTLA-4的三联疗法显示出最佳的抗肿瘤效果。体内原位肿瘤模型实验进一步证实,这种三联疗法在所有研究的治疗方案中表现出最佳的抗肿瘤效果。
此外,无论是皮下还是原位模型,肿瘤荷载小鼠对组合疗法的耐受性良好,未观察到明显的肝肾功能损害。通过分析肿瘤组织中铁死亡标志物,进一步证实了三联疗法显著提高了肿瘤中铁死亡水平。
通过上述证据,我们证明了GSK2656157、erastin和抗CTLA-4联合治疗的有效性和安全性。此外,对原位肿瘤的IHC分析显示,联合治疗增加了异种移植肿瘤中的铁死亡,并促进了CD8+ T细胞的浸润。
综上所述,我们的研究结果表明,cTRIP12是PDAC铁死亡和免疫治疗的一个可靶向生物标志物,而GSK2656157、erastin和抗CTLA-4的三联疗法可能为PDAC患者提供一种有前景的治疗方案。
最后,我们评估了PDAC患者中cTRIP12的表达、磷酸化OGT水平和PD-L1状态,并同时分析了Kras/TP53突变。
与上述结果一致,高cTRIP12表达与显著升高的磷酸化OGT和增加的PD-L1阳性率相关,而低表达则与显著降低的磷酸化OGT和减少的PD-L1阳性率相关。
值得注意的是,cTRIP12的表达与Kras/TP53突变没有显著关联。这些数据表明,cTRIP12是PDAC中一个不依赖于Kras/TP53突变的生物标志物。
总之,这项研究证明了高cTRIP12表达在PDAC中的重要性,并通过cTRIP12-PERK-OGT信号通路建立了铁死亡抵抗与免疫抑制之间的联系。
针对这一途径可能为肿瘤细胞和抗肿瘤免疫环境中铁死亡的正常化提供新的机会,通过选择性靶向PERK实现。
因此,cTRIP12可作为PDAC患者的潜在治疗生物标志物,而三联疗法为缓解PDAC进展提供了潜在的临床可能性。
作者使用伯信生物明星产品RAP试剂盒进行了上述筛选与分子互作调控机制的研究。
RAP Kit
产品介绍:
RNA 反义纯化技术(RNA Antisense Purification,RAP)用于研究RNA与RNA、RNA与蛋白质之间的相互作用。根据研究对象不同,RAP技术结合了高通量测序(RAP-Seq)和质谱技术(RAP-MS),分别研究与目标RNA互作的RNA和蛋白质。
伯信 RAP Kit分为:
Bes5103-1(S) RAP-RNA kit 12T
Bes5103-1(N) RAP-RNA kit 30T
Bes5103-2(S) RAP-Protein kit 12T
Bes5103-2(N) RAP-Protein kit 30T
Bes5103-3(S) RAP-RNA、protein kit 12T
Bes5103-3(N) RAP-RNA、protein kit 30T
实验原理:
RAP技术通过设计生物素探针组拉取目标RNA,使与其共同作用的RNA或蛋白质(RBPs)富集在磁珠上并被洗脱。最后,通过高通量测序得到该调控RNA转录调控的下游靶基因,同时,也可以通过Western Blot验证RBPs,或通过MS鉴定未知蛋白。
技术流程:
结果实例:
产品优势:
1. 伯信独立研发,具有自主知识产权。
2. 灵敏度高,稳定性好。
3. 检测方法领先,结果准确、重复性好。




