Intranuclear paraspeckle-circular RNA TACC3 assembly forms RNA-DNA hybrids to facilitate MASH-related hepatocellular carcinoma growth in an m6A-dependentManner
(IF=24.8996)《Cancer Communications》
摘要
背景:
代谢功能障碍相关脂肪性肝炎(MASH)预计将成为肝细胞癌(HCC)的主要原因。越来越多的证据表明,N6-甲基腺苷(m6A)修饰的环状RNA(circRNAs)在肿瘤恶性进展中起关键作用。
然而,环状RNA及其m6A修饰调控网络如何响应代谢重编程(如脂质过载应激)以驱动MASH相关 HCC 背景下恶性肿瘤进展的具体分子机制尚不清楚。本研究旨在探讨m6A修饰环状RNA在MASH相关 HCC 中的作用及调控网络。
方法:
使用转录组微阵列和原位杂交检测验证了MASH相关 HCC 标本中circTACC3的表达。棕榈酸(PA)和油酸(OA)被应用于NAC-organ组装的三维类器官和 HCC 细胞系,以模拟病理性的脂质过载。利用荧光寿命成像显微镜-福斯特共振能量转移技术研究了circTACC3-副斑点相互作用。
通过结合DNA-RNA免疫沉淀与RNA纯化染色质分离(DRIP-ChIRP)、靶向和标签化下的 γH2AX 切割以及高通量/分辨率染色体构象捕获测序的整合分析,研究了脂质过载期间circTACC3形成的RNA-DNA杂合体(R环)在DNA双链断裂(DSB)位点诱导的染色质重塑。
结果:
在MASH相关的 HCC 中,最普遍的m6A修饰环状RNA是circTACC3,它对肿瘤细胞的细胞内脂质积累、生长和环境适应性生存有重大影响。在脂质过载条件下,circTACC3直接与不含POU结构域的八聚体结合蛋白(NONO /p54nrb)相互作用,组装成核内副斑点。
这一过程依赖于circTACC3的m6A修饰位点,并促进其核内滞留。通过DRIP-ChIRP测序,我们证明了含有circTACC3的副斑点被招募到DSB焦点处形成R环(DSB-circTACC3-R环)。我们发现了4个高度富集的DSB-circTACC3-R环基序。
DSB-circTACC3-R环进一步促进了拓扑关联域(TADs)的接触和融合,并选择性激活与MASH相关 HCC 恶性表型相关的基因。有趣的是,circTACC3-R环对circTACC3副斑点的组装和TADs的聚集产生了正反馈控制。
结论:
m6A修饰依赖的circTACC3-副斑点组装导致DSB焦点处形成R环,从而引起染色质重塑和与MASH相关的 HCC 恶性进展相关基因的激活。这一过程确定了潜在的治疗靶点。
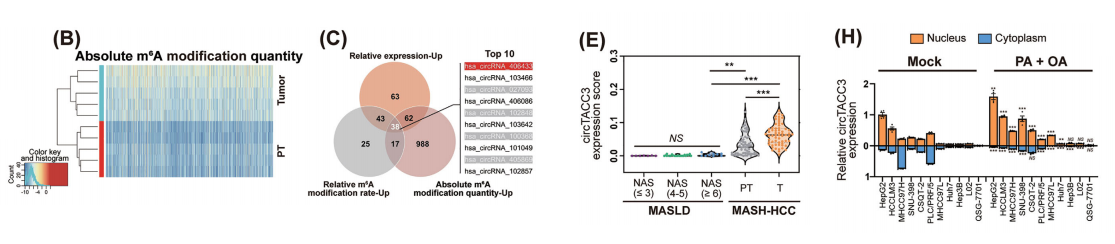
利用m6AcircRNA表观转录组微阵列技术,检测了5例人类MASH相关 HCC 肿瘤及其配对的瘤周正常组织,以鉴定MASH相关 HCC 中m6A修饰的环状RNA。共有1,105个环状RNA的绝对m6A修饰量显著增加。
其中,38个环状RNA在m6A修饰和相对表达水平上均显著增加,而circTACC3是一种尚未功能表征的新型环状RNA,其绝对m6A修饰量的增加最为显著。
ISH检测在38个人类 MASLD 组织。ISH检测显示,circTACC3在MASH相关 HCC 肿瘤组织中表达最高,而在 HBV 相关 HCC 肿瘤及其配对的邻近组织中未检测到circTACC3。
与m6A-circRNA表观转录组微阵列分析的结果一致,MeRIP检测显示,在MASH相关的 HCC 肿瘤中,m6A修饰的circTACC3比例较高。
有趣的是,与配对的瘤周正常组织、 MASLD 组织和 HBV 相关的 HCC 肿瘤组织相比,MASH相关的 HCC 肿瘤组织中circTACC3的核定位显著增强。
这一发现与NAC-Organ组装的MASH相关的 HCC 肿瘤3D类器官中观察到的circTACC3核分布一致。
肝细胞对脂毒性适应,以及由脂质过载诱导的活性氧生成和DNA损伤反应的激活,被认为是MASH相关 HCC 肿瘤发生的关键因素。脂质过载条件下circTACC3亚细胞分布的改变在不同细胞系中差异显著。
Huh7和Hep3B细胞,以及正常肝细胞系L02和 QSG -7701,其核内circTACC3表达水平低于HepG2和HCCLM3细胞。
综合研究显示circTACC3在细胞质和细胞核中的分布表明,在脂质过载条件下,其生物合成增加、核内滞留或可能的核转位可能导致其在细胞核内积累。
研究发现circTACC3的序列与其宿主基因第4外显子通过头尾连接剪接产生的序列完全一致。此外,circTACC3对RNase R消化表现出显著抗性,且其半衰期较同源mRNA更长。
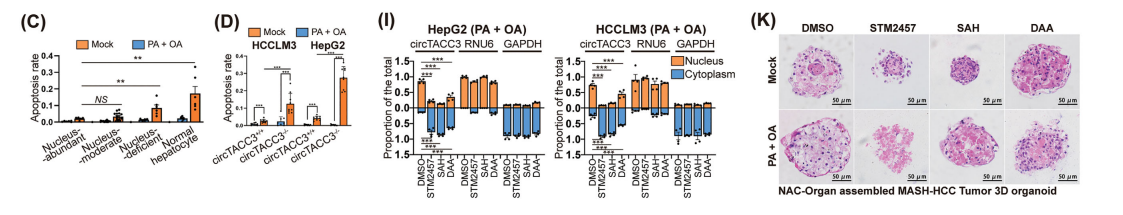
为了研究circTACC3在MASH相关 HCC 中的致癌功能,我们用PA和OA处理了MASH相关 HCC 肿瘤及其配对的瘤周正常组织来源的类器官,并检测到脂质过量积累。
与配对的瘤周正常组织来源的类器官相比,MASH相关 HCC 肿瘤类器官体积更大,增殖活性更高,且凋亡率更低。
在脂质过载条件下,核内circTACC3表达较高的MASH相关 HCC 类器官表现出比circTACC3表达较低的类器官更好的生存能力和更高的脂质积累。
在PA和OA处理下,与核缺陷型或正常肝细胞系相比,circTACC3核富集的 HCC 细胞系表现出减少的凋亡。
随后,我们通过使用靶向circTACC3 Alu元件的 CRISPR -Cas9创建的circTACC3敲除细胞,研究了circTACC3在脂质过载条件下控制 HCC 细胞活力的作用,以确保其不会干扰TACC3成熟线性转录本的形成。
与野生型细胞(circTACC3+/+)相比,circTACC3−/−细胞在PA和OA处理后表现出增加的凋亡和减少的脂质积累。
F2-circTACC3下拉实验后进行的蛋白质印迹分析显示,甲基转移酶样3、甲基转移酶样14以及病毒样m6A甲基转移酶相关蛋白,可以与circTACC3相互作用。
MeRIP检测显示HCCLM3和HepG2细胞中circTACC3的m6A修饰水平更高。此外,核内circTACC3的m6A修饰水平显著高于胞质circTACC3,表明circTACC3的m6A修饰与其细胞内定位存在相关性。
对核内circTACC3特定m6A修饰的基序水平分析显示,共有5个可能修饰位点:其中4个位点的修饰率>95%,而第153位点的修饰率>70%。
我们通过点印迹实验和甲基化RNA免疫沉淀实验证实,PA和OA诱导的脂质过载分别增加了整体m6A修饰水平和circTACC3特异性m6A修饰水平。在正常培养和脂质过载条件下,所有m6A抑制剂均降低了整体和circTACC3特异性m6A修饰水平。
如预期,m6A干扰减少了脂质过载诱导的circTACC3核定位和斑点样聚集。在MASH相关的 HCC NAC-Organ组装的3D类器官中也观察到了相同现象。
此外,在模拟培养条件以及PA和OA补充的培养条件下,m6A修饰干扰导致MASH相关的 HCC NAC-Organ组装的3D类器官体积减小、形态受损,同时细胞内脂质积累减少、增殖受到抑制以及凋亡增加。
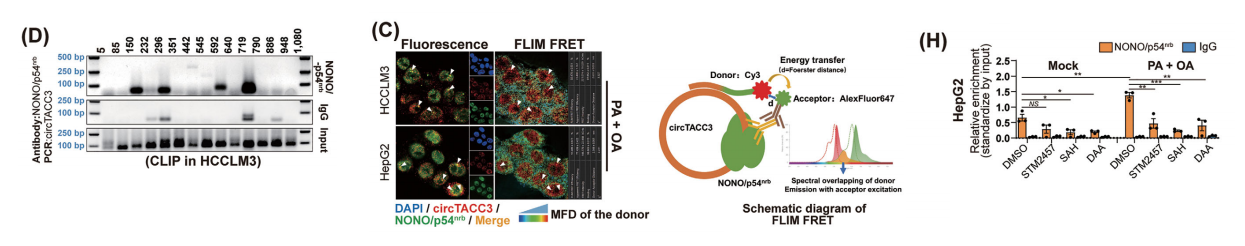
作为脂质过载条件下定位于细胞核的RNA,环状TACC3在细胞核中形成了高度聚集的焦点,这表明其核定位可能与副斑点有关。
F2-circTACC3 下拉后进行液相色谱-串联质谱,以及 蛋白质印迹显示了 NONO /p54nrb 蛋白质被 circTACC3 富集。同时,使用抗 NONO /p54nrb 抗体的 RIP 实验显示了 NONO /p54nrb 相关 RNA 中 circTACC3 的富集。
荧光寿命成像显微镜-福斯特共振能量转移(FLIM -FRET)检测进一步证实了circTACC3与 NONO /p54nrb之间高置信度的直接相互作用,特别是在它们高度聚集的区域。CLIP检测显示,在circTACC3存在4个潜在的特异性 NONO /p54nrb相互作用片段。
我们还发现了circTACC3与LncNEAT1(另一种副斑点生物标志物)之间的相互作用,以及在脂质过载条件下circTACC3、 NONO /p54nrb和LncNEAT1信号的聚集。
相应地, NONO /p54nrb和LncNEAT1的敲低减少了脂质过载诱导的circTACC3的核内定位和聚集。
在已鉴定的circTACC3中的m6A修饰位点中,153、317和763位点位于circTACC3- NONO /p54nrb相互作用片段内。
干扰m6A修饰抑制了circTACC3- NONO /p54nrb的相互作用,以及circTACC3- NONO /p54nrb的共定位和共聚集。
此外,在甲基转移酶表达较低且circTACC3 m6A修饰的Hep3B细胞中,PA和OA未能诱导过表达的circTACC3与副斑点的共定位。
在同时过表达METTL3以增加m6A修饰后,PA和OA有效增加了过表达的circTACC3与高度聚集的 NONO /p54nrb的共定位。
这些结果表明,m6A修饰对于circTACC3与 NONO /p54nrb在MASH相关 HCC 细胞核内的共聚集至关重要。与这些发现一致的是,FISH-IF和RIP实验显示,m6A修饰位点153、317和763的突变显著抑制了circTACC3- NONO /p54nrb的共定位和共聚集。
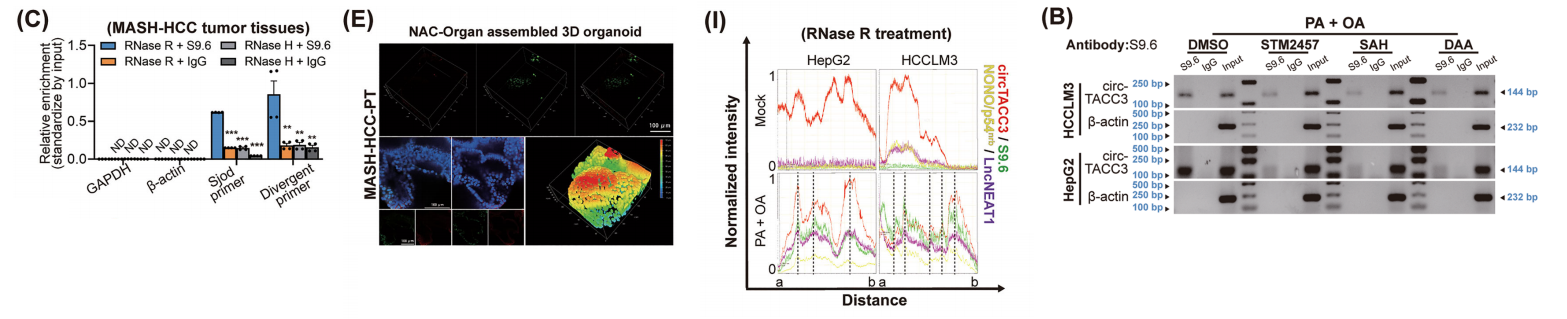
我们通过一系列全面的实验,调查了MASH相关 HCC 肿瘤基因组中由circTACC3形成的R环结构的存在。这些R环对RNase R消化表现出抗性,但对RNase H和DNase I处理敏感,这与先前报道的环状R环特性一致。
通过在人MASH相关 HCC 肿瘤组织中进行DRIP,以及在人MASH相关 HCC 肿瘤组织和肿瘤组织来源的类器官中进行FISH-IF检测,我们进一步证实了高度聚集的circTACC3参与了R环的形成。
经过RNase R消化后,环状R环被突出显示,因此观察到dRNase H1与环状TACC3之间更特异的共定位。
此外,在脂质过载条件下,检测到 HCC 细胞中副斑点、circTACC3和R环的共聚集。相应地, NONO /P54nrb和LncNEAT1的干扰抑制了脂质过载诱导的circTACC3-R环形成。
在脂质过载条件下,全局m6A修饰干扰破坏了circTACC3在R环中的富集,其共定位也是如此,在类器官和体外 HCC 细胞模型中均如此。当脂质过载诱导的 HCC 细胞中的R环通过可诱导表达的RNase H1进行干扰时,circTACC3的核定位受到影响。
此外,circTACC3- NONO /p54nrb的共定位和共聚集也受到阻碍。这些发现表明,R环对于维持高度聚集的副斑点和circTACC3至关重要。
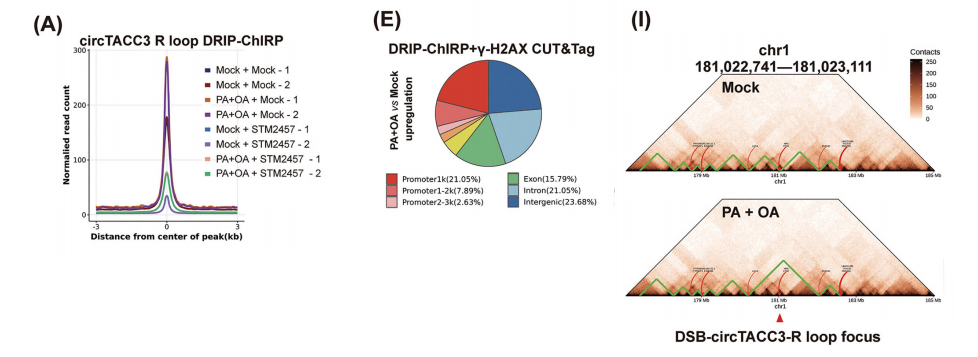
我们通过DRIP实验从脂质过载诱导的 HCC 细胞中富集了circR环。我们设计了一种特异性靶向circTACC3 BSJ 区域的寡核苷酸探针,并使用ChIRP实验选择性富集由内源性circTACC3形成的circR环,命名为“DRIP-ChIRP”方法,通过该方法检测到circTACC3在全局circR环和circTACC3-R环中的特异性富集。
脂质过载增加了基因间区和内含子区域的circTACC3-R环数量。在正常和脂质过载条件下,m6A修饰抑制均降低了circTACC3-R环的形成。
受脂质过载和m6A修饰调控的circTACC3-R环主要位于内含子、基因间区和启动子区域。GO富集分析显示,这些circTACC3-R环结合位点包含参与细胞膜脂质转运、细胞内脂质运输及固醇转运等细胞功能相关基因。
我们观察到,在 HCC 细胞中,脂质过载诱导后,副斑点、circTACC3-R环和DNA双链断裂(DSB)焦点呈现高度聚集的共定位。
此外,通过CUT&Tag测序发现,PA和OA诱导的DSB整体增加,其中启动子区域的变化最为显著。
随后将CUT&Tag测序数据与DRIP-ChIRP测序数据结合分析,共鉴定出38个位于DSB焦点的脂质过载诱导的circTACC3-R环,并命名为“DSB相关且circTACC3形成的环状R环”(DSB-circTACC3-R环)。
在这些DSB-circTACC3-R环中,与DSB共定位变化最显著的位于启动子区域。进一步揭示了与DSB-circTACC3-R环结合的4个最富集基序,这些基序均与circTACC3序列高度互补。
为了进一步探索circTACC3在基因组组织中的具体功能,我们通过Hi-C数据分析了三维基因组组织。脂质过载并未显著改变全基因组范围内的染色体相互作用,也未引发基因组区室化的主要变化。
脂质过载诱导后形成的高度聚集的共定位区域,包括副斑点、circTACC3-R环和DSB焦点,可以与多个其他高度聚集的共定位区域相互作用。
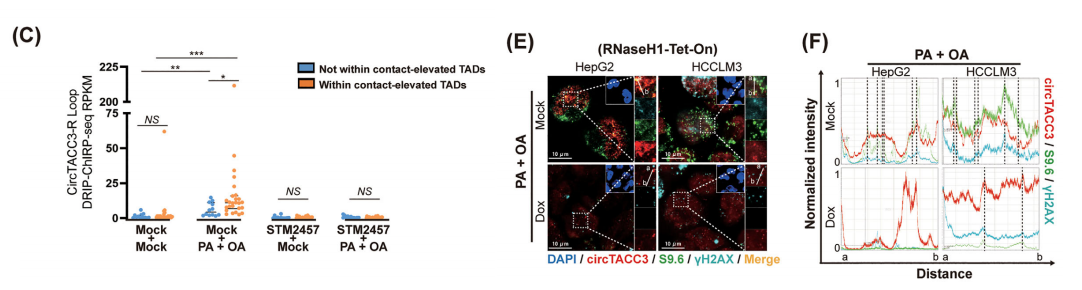
这一现象随后通过活细胞成像动态观察到在 NONO /p54nrb-mCherry HepG2细胞中。在聚焦于TADs尺度时,我们观察到DSB-circTACC3-R环与表现出更高TAD间接触频率的TADs在物理上共定位,这既存在于长程TADs内部,也存在于相邻TADs中;我们将这些TADs称为“接触增强型TADs”。
与此一致的是,在脂质过载诱导后,我们也在DSB-circTACC3-R环定位的焦点处观察到TAD融合现象,该现象被定义为由于相邻TADs间相互作用增强导致的TAD边界丢失。
针对38个DSB-circTACC3-R环定位基因的相应转录本设计了引物用于RT-qPCR分析,其中35个基因在脂质过载诱导的HepG2细胞中表达量高于模拟组。
部分DSB-circTACC3-R环定位基因被注释为参与增殖调控、脂质代谢以及DNA损伤应答。
此外,我们还发现STX6,一个先前与 HCC 进展相关的基因,在由circTACC3介导的脂质过载诱导的染色质重塑中被转录激活。
STX6的干扰始终导致促进细胞凋亡并抑制 HCC 细胞增殖;然而,STX6的干扰对脂质积累的影响微乎其微,这表明circTACC3可能选择性地调控特定下游基因,促进MASH相关 HCC 的恶性进展。
此外,我们观察到在“接触增强的TADs”中,位于DSB-circTACC3-R环内的基因数量显著多于这些TADs外的基因,这表明这些基因是响应脂质过载诱导的TADs接触增强而选择性激活的。
在38个DSB-circTACC3-R环中,位于接触增强的TADs内的部分在脂质过载条件下表现出显著更高的R环形成频率。
这种接触增强与非接触增强TADs之间circTACC3 R环富集的差异在m6A干预后消失,并在脂质过载条件下尤为突出。然而,这两个区域之间的DSB信号并无显著差异。
可诱导消除的R环结构抑制了circTACC3在DSB焦点处的聚集。此外,活体成像显示,在消除R环后,DSB-circTACC3-R环和 NONO /p54nrb聚集均消失。
这一模式表明,circTACC3-R环结构是脂质过载条件下增加TAD间接触的关键因素。
我们的研究结果表明,m6A修饰依赖的circTACC3-副斑点组装在DSB焦点处形成Rloop,以促进MASH相关 HCC 恶性进展。阐明这一机制有望揭示新的靶点和治疗选择。


作者使用伯信生物明星产品CLIP、ChIRP进行分子调控机制研究。
CLIP Kit
产品介绍
CLIP (crosslinking-immunprecipitation)是利用蛋白质和RNA在365 nm紫外光照射下会发生共价交联的特性,来研究蛋白质和RNA相互作用的重要技术。
伯信 CLIP Kit分为:
Bes3014-1 CLIP-qPCR Kit 12T
Bes3014-1 CLIP-qPCR Kit 30T
Bes3014-2 CLIP-seq Kit 12T
Bes3014-2 CLIP-seq Kit 30T
实验原理:
CLIP-qPCR(crosslinking-immunprecipitation and qPCR)即紫外交联免疫沉淀结合qPCR定量技术,通过免疫共沉淀RBP与RNA的结合复合物,获取消化(蛋白酶K、DNaseI、RNase T1)后的RNA,对RNA 3’端加接头,以及设计不同位点的引物,进行RNA结合蛋白位点的富集效率检测。
CLIP-seq(crosslinking-immunprecipitation and High throughput sequencing)即紫外交联免疫沉淀结合高通量测序技术,通过免疫共沉淀RBP与RNA的结合复合物,获取纯化及消化(蛋白酶 K、DNaseI、RNase T1)后的RNA,进行cDNA文库构建与测序分析。
技术流程:
结果实例:
产品优势:
1.经紫外照射,细胞内的RNA与相应的RNA结合蛋白交联,增强RNA与蛋白的结合能力
2.可检测多种RNA,如LncRNA、mRNA、microRNA
3. CLIP-qPCR可精确定位RNA与蛋白的结合位点
4.自主知识产权
ChIRP Kit
产品介绍:
ChIRP(Chromatin Isolation by RNA Purification)是一项研究RNA与DNA及蛋白质之间相互作用的技术。根据研究对象不同,ChIRP技术可分别结合高通量测序(ChIRP-Seq)和质谱技术(ChIRP-MS),研究与目标RNA互作的基因和蛋白质。
伯信 ChIRP Kit分为:
Bes5104-1(S) ChIRP-DNA Kit 12T
Bes5104-1(N) ChIRP-DNA Kit 30T
Bes5104-2(S) ChIRP-Protein Kit 12T
Bes5104-2(N) ChIRP-Protein Kit 30T
Bes5104-3(S) ChIRP-DNA、Protein Kit 12T
Bes5104-3(N) ChIRP-DNA、Protein Kit 30T
实验原理:
ChIRP方法通过设计生物素标记RNA互补探针,并使其与链霉亲和素结合,这样,在探针与目标RNA特异性结合的同时,捕获RNA结合调控的DNA染色体片段与参与转录调控的RNA结合蛋白质(RBPs)。
DNA染色体片段经过文库构建与高通量测序,在基因组水平上获得转录调控RNA(增强子RNA, eRNA)调控的下游靶基因,结合qPCR可以研究结合调控强度; RNA结合蛋白经过酶消化与高效液相-质谱分析,可以鉴定参与转录调控的蛋白质,结合Western Blot可以进一步研究结合作用强度。
技术流程:
结果实例:
产品优势:
1. 伯信独立研发,具有自主知识产权。
2. 特异性和灵敏度高,稳定性好。
3. 检测方法好,结果准确、重复性好。
4. 快速检测,操作简单,安全便捷。




